题目内容
2.日常生活中的塑料包括很多种,其中PET(聚对苯二甲酸乙二醇酯)塑料被广泛用于生产包装瓶、电器元件、汽车配件等;PS塑料被广泛应用于光学工业中,PET塑料、PS塑料可按下图所示合成.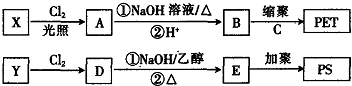
已知:
 →
→
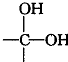
(1)C能与含氧酸发生酯化反应,则C的分子式为C2H6O2,其所含的官能团的名称为羟基.
(2)X、Y互为同分异构体,分子式为C8H10,则X的结构简式为
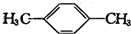 ,其核磁共振氢谱有2种峰.
,其核磁共振氢谱有2种峰.(3)D分子中含有一个甲基,则D→E的化学方程式为
 ,
,E与CH2=CH-CH=CH2在一定条件下1:1发生反应生成除苯环外无支链的高聚物的化学方程式为
 .
.(4)Z是B的同分异构体,其具有如下性质:①遇FeCl3溶液显紫色;②能与NaHCO3溶液反应放出CO2;③苯环上的一氯代物只有三种;④苯环上只有2个取代基相邻.则Z的结构最多有6种,写出其中一种的结构简式
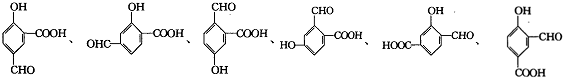 (其中一种).
(其中一种).
分析 PET为聚对苯二甲酸乙二醇酯,对应的单体应该是对苯二甲酸、乙二醇,C能与含氧酸发生酯化反应,则C为乙二醇,分子式为C2H6O2,官能团是羟基;C8H10为乙苯或二甲苯,B为对苯二甲酸,X为对二甲苯,甲基上的氢均被氯原子取代生成A(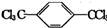 ),A水解后生成B(
),A水解后生成B(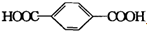 ),X、Y互为同分异构体,分子式为C8H10,由D→E的反应条件知相应的反应为消去反应,E能发生加聚反应,说明Y为乙苯,D中有甲基,则D的结构式为
),X、Y互为同分异构体,分子式为C8H10,由D→E的反应条件知相应的反应为消去反应,E能发生加聚反应,说明Y为乙苯,D中有甲基,则D的结构式为 ,E为苯乙烯,苯乙烯发生加聚反应得PS,据此答题.
,E为苯乙烯,苯乙烯发生加聚反应得PS,据此答题.
解答 解:PET为聚对苯二甲酸乙二醇酯,对应的单体应该是对苯二甲酸、乙二醇,C能与含氧酸发生酯化反应,则C为乙二醇,分子式为C2H6O2,官能团是羟基;C8H10为乙苯或二甲苯,B为对苯二甲酸,X为对二甲苯,甲基上的氢均被氯原子取代生成A( ),A水解后生成B(
),A水解后生成B( ),X、Y互为同分异构体,分子式为C8H10,由D→E的反应条件知相应的反应为消去反应,E能发生加聚反应,说明Y为乙苯,D中有甲基,则D的结构式为
),X、Y互为同分异构体,分子式为C8H10,由D→E的反应条件知相应的反应为消去反应,E能发生加聚反应,说明Y为乙苯,D中有甲基,则D的结构式为 ,E为苯乙烯,苯乙烯发生加聚反应得PS,
,E为苯乙烯,苯乙烯发生加聚反应得PS,
(1)根据上面的分析可知,C的分子式为 C2H6O2,其所含的官能团是羟基,
故答案为:C2H6O2;羟基;
(2)根据上面的分析可知,X为对二甲苯,结构简式为 ,其核磁共振氢谱有2种峰,
,其核磁共振氢谱有2种峰,
故答案为: ;2;
;2;
(3)D的结构式为 ,则D→E的化学方程式为
,则D→E的化学方程式为  ,E为苯乙烯,因苯乙烯与CH2=CH-CH=CH2反应生成的物质除苯环外无支链,故二者之间发生的是1,4-加成型的加聚反应,化学方程式为
,E为苯乙烯,因苯乙烯与CH2=CH-CH=CH2反应生成的物质除苯环外无支链,故二者之间发生的是1,4-加成型的加聚反应,化学方程式为 ,
,
故答案为: ;
; ;
;
(4)Z是B的同分异构体,其具有如下性质:①遇FeCl3溶液显紫色,说明有酚羟基,②能与NaHCO3溶液反应放出CO2,说明有羧基,③苯环上的一氯代物只有三种,④苯环上只有2个取代基相邻,则符合条件的Z的结构为 ,共有6种,
,共有6种,
故答案为:6; (其中一种).
(其中一种).
点评 本题考查有机物推断与合成,是对有机化学基础的综合考查,需要学生熟练掌握官能团的性质与转化,要学会书写有条件的同分异构体,难度中等.

| A. | 乙烯的比例模型: | B. | 丙烷分子的球棍模型: | ||
| C. | 醋酸钠的分子式:CH3COONa | D. | 乙酸的结构简式:CH3COOH |
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
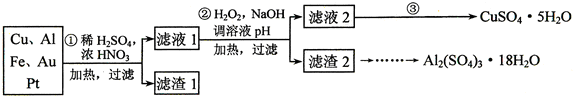
(2)第②步中加入H2O2的作用是将Fe2+氧化为Fe3+,使用H2O2的优点是过氧化氢做氧化剂不引入杂质,对环境无污染;调溶液pH的目的是使Fe3+、Al3+沉淀除去.
(3)简述第③步由滤液2得到CuSO4•5H2O的方法是加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体
(4)由滤渣2制取Al2(SO4)3•18H2O,设计了以下三种方案:
甲:滤渣2$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{蒸发、冷却、结晶、过滤}^{\;}$Al2(SO4)3•18H2O
乙:滤渣2$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量AI粉}$滤液$→_{蒸发、冷却、结晶、过滤}^{.}$Al2(SO4)3•18H2O
丙:滤渣2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$→_{蒸发、冷却、结晶、过滤}^{\;}$Al2(SO4)3•18H2O
上述三种方案中,甲方案不可行,原因是所得产品中含有较多Fe2(SO4)3杂质;从原子利用率角度考虑,乙方案更合理.
(5)用滴定法测定CuSO4•5H2O含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c
mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2-→CuY2-+
2H+.写出计算CuSO4•5H2O质量分数的表达式ω=$\frac{c×b×1{0}^{-3}×250×5}{a}$×100%.
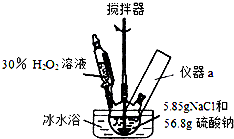 4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:
4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:Ⅰ.合成:往三颈瓶中加入56.8g硫酸钠和5.85gNaCl的固体混合物,开启搅拌器;将稍过量的(约70mL)30%H2O2溶液在20~30min内逐滴分批加入.并控制反应温度15~35℃,加完料后持续搅拌15min,反应结束后过滤,低温干燥得到产品.
Ⅱ.产品稳定性分析:取Ⅰ中所得产品置于干燥器内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol/L酸性高锰酸钾滴定,测定产品中双氧水的含量,以此分析产品的稳定性.所得实验数据如表
数据 时间 | 样品取用数量(g) | 平均V(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.90 |
b.产品稳定性=(放置一个月后双氧水的质量分数/放置前双氧水的质量分数)×100%
请回答下列问题:
(1)装置图里方框中应添加仪器a,其名称为温度计;写出合成4Na2SO4•2H2O2•NaCl的化学方程式:4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl.
(2)该合成反应过程中,关键是控制温度,其合理的措施是:ACD
A.逐滴滴加H2O2 B.选用Na2SO4和NaCl固体,而不用其饱和溶液
C.不断搅拌 D.冰水浴
(3)该合成反应过程中30%的H2O2溶液不应大大过量的原因减小产品的溶解损失,提高产率.
(4)4Na2SO4•2H2O2•NaCl固体比过碳酸钠(2Na2CO3•3H2O2)固体更稳定的可能原因是_2Na2CO3•3H2O2中碳酸钠水解呈碱性,而双氧水在碱性条件容易分解.
(5)产品分析实验时,高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是溶液从无色刚好变为浅红色,且保持30s不褪色.
下列关于该滴定实验过程中的仪器选择和操作都正确的是AC
(6)该产品的“产品稳定性”=99.6%.
| A. | 三种元素的最高正价氧化物的相应水化物之间能两两反应 | |
| B. | Ym+的半径最小 | |
| C. | Y元素一定是金属元素 | |
| D. | 原子半径:Z>X>Y |
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
| A. | 0.1g | B. | >0.1g | C. | <0.1g | D. | 无法确定 |
| A. | 高强度水泥 | B. | 钢化玻璃 | C. | 碳化硼陶瓷 | D. | 钢铁 |
| A. | ($\frac{b}{A}$)(A-N)mol | B. | ($\frac{b}{A}$)(A-N+m)mol | C. | $\frac{b}{A+m}$(A-N)mol | D. | $\frac{b}{A+m}$(A-N+m)mol |