题目内容
10.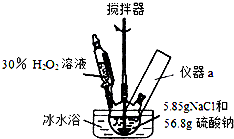 4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:
4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:Ⅰ.合成:往三颈瓶中加入56.8g硫酸钠和5.85gNaCl的固体混合物,开启搅拌器;将稍过量的(约70mL)30%H2O2溶液在20~30min内逐滴分批加入.并控制反应温度15~35℃,加完料后持续搅拌15min,反应结束后过滤,低温干燥得到产品.
Ⅱ.产品稳定性分析:取Ⅰ中所得产品置于干燥器内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol/L酸性高锰酸钾滴定,测定产品中双氧水的含量,以此分析产品的稳定性.所得实验数据如表
数据 时间 | 样品取用数量(g) | 平均V(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.90 |
b.产品稳定性=(放置一个月后双氧水的质量分数/放置前双氧水的质量分数)×100%
请回答下列问题:
(1)装置图里方框中应添加仪器a,其名称为温度计;写出合成4Na2SO4•2H2O2•NaCl的化学方程式:4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl.
(2)该合成反应过程中,关键是控制温度,其合理的措施是:ACD
A.逐滴滴加H2O2 B.选用Na2SO4和NaCl固体,而不用其饱和溶液
C.不断搅拌 D.冰水浴
(3)该合成反应过程中30%的H2O2溶液不应大大过量的原因减小产品的溶解损失,提高产率.
(4)4Na2SO4•2H2O2•NaCl固体比过碳酸钠(2Na2CO3•3H2O2)固体更稳定的可能原因是_2Na2CO3•3H2O2中碳酸钠水解呈碱性,而双氧水在碱性条件容易分解.
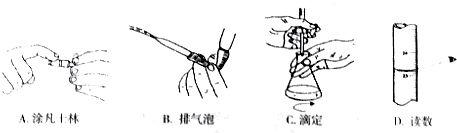
(5)产品分析实验时,高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是溶液从无色刚好变为浅红色,且保持30s不褪色.
下列关于该滴定实验过程中的仪器选择和操作都正确的是AC
(6)该产品的“产品稳定性”=99.6%.
分析 (1)根据控制反应温度15~35℃可知,装置中必须要有温度计,根据题中提供的物质,利用元素守恒可写化学方程式;
(2)控制反应放出的热量可以通过控制反应物的量,也可以通过搅拌、冰水浴等方式促使热量散失等措施;
(3)因为双氧水不稳定,所以合成反应过程中30%的H2O2溶液适当过量,但不能太多,双氧水太多,4Na2SO4•2H2O2•NaCl在其中的溶解的量就多,产品的产率低;
(4)2Na2CO3•3H2O2中碳酸钠水解呈碱性,而双氧水在碱性条件容易分解;
(5)根据高锰酸钾溶液本身的颜色的变化判断滴定的终点,根据滴定操作的规范要求选择;
(6)根据产品用去的高锰酸钾溶液的体积可计算出产品中双氧水的质量分数,利用产品稳定性=(放置一个月后双氧水的质量分数/放置前双氧水的质量分数)×100%计算.
解答 解:(1)根据控制反应温度15~35℃可知,装置中必须要有温度计,所以方框中应添加仪器a为温度计,合成4Na2SO4•2H2O2•NaCl的化学方程式为4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl,
故答案为:温度计;4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl;
(2)控制温度可以控制反应放出的热量可以通过控制反应物的量,也可以通过搅拌、冰水浴等方式促使热量散失等措施达到控制温度的目的,
故选:ACD;
(3)因为双氧水不稳定,所以合成反应过程中30%的H2O2溶液适当过量,但不能太多,双氧水太多,4Na2SO4•2H2O2•NaCl在其中的溶解的量就多,产品的产率低,所以30%的H2O2溶液不应大大过量,以减小产品的溶解损失,提高产率,
故答案为:减小产品的溶解损失,提高产率;
(4)2Na2CO3•3H2O2中碳酸钠水解呈碱性,而双氧水在碱性条件容易分解,所以4Na2SO4•2H2O2•NaCl固体比过碳酸钠(2Na2CO3•3H2O2)固体更稳定,
故答案为:2Na2CO3•3H2O2中碳酸钠水解呈碱性,而双氧水在碱性条件容易分解;
(5)高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是溶液从无色刚好变为浅红色,且保持30s不褪色,右滴定过程中涂凡士林可以防止活塞少漏液体,故A正确;排气泡时速度不能太快,要慢慢挤出气泡,故B错误;测定时一手握住活塞,另一手拿住锥形瓶,并不断振荡,故C正确,读数是目光要平视液面,故D错误,故选AC,
故答案为:溶液从无色刚好变为浅红色,且保持30s不褪色;AC;
(6)根据产品用去的高锰酸钾溶液的体积可计算出产品中双氧水的质量分数,两次用的是同一份样品,所以有高锰酸钾溶液的体积之比=双氧水的质量分数之比,所以产品稳定性=(放置一个月后双氧水的质量分数/放置前双氧水的质量分数)×100%=$\frac{24.9}{25}$×100%=99.6%,
故答案为:99.6%.
点评 本题考查了4Na2SO4•2H2O2•NaCl的制备及性质实验方案设计,侧重于制备实验操作、物质的分离提纯、离子方程式的书写、数据的处理和计算、滴定原理的应用等知识点的考查,清楚制备的原理是解答的关键,题目难度中等.

 在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数减小.达到平衡时,A的体积分数小于0.5 | |
| D. | 200℃时,起始向容器中充入0.2 mol A、0.4 mol B和0.4 mol C,反应达到平衡前的速率:v(正)<v(逆) |
| A. | 10种 | B. | 8种 | C. | 6种 | D. | 4种 |
(2)氨在氧气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=-572kJ•mol-1
则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2+3H2$?_{高温高压}^{催化剂}$2NH3)在25℃、400℃的平衡常数分别为5×105和200.
①合成氨是放热反应(填“放热”或“吸热”).
②合成氨选择400~500℃的原因是:加快反应速率,催化剂活性最大.
③在容积固定的密闭容器中发生上述反应,如表中为各物质在不同时刻的浓度.
| 时间/min | c(N2)/mol•L-1 | c(H2)/mol•L-1 | c(NH3)/mol•L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.使用催化剂 b.降低温度 c.增加氢气的浓度 d.分离出NH3
(4)在-50℃时,液氨中存在电离平衡NH3(l)?NH4++NH2-,离子积常数K=c(NH+4)•c(NH2-).若一定条件下,平衡时c(NH2-)=1×10-15 mol•L-1,下列说法正确的是b.
a.在液氨中加入NaNH2,液氨的离子积常数增大b.此温度下液氨的离子积常数为1×10-30c.液氨在-50℃的电离程度比常温下纯水的大
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn+2OH--2e-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-═FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化.
| A. | 在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA | |
| B. | 电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜 | |
| C. | 2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023 |
| A. | Na2O2和NaOH | B. | CH3COONa和NaOH | C. | CCl4和H2O | D. | CO2和H2O2 |
| A. | Al2O3是氧化剂 | B. | N2被氧化 | ||
| C. | AlN的摩尔质量为41 g | D. | 生成1 mol AlN转移3 mol电子 |
| A. | 常温常压下,16gO2含有的核外电子数为8 NA | |
| B. | 一定条件下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3 NA | |
| C. | 标准状况下,22.4L氨水含有NA个NH3分子 | |
| D. | 28gC2H4中含有C-H键的数目为3 NA |
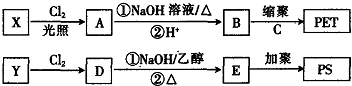
 →
→
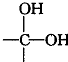
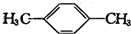 ,其核磁共振氢谱有2种峰.
,其核磁共振氢谱有2种峰. ,
, .
.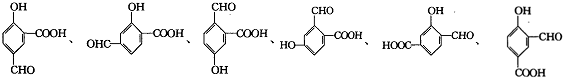 (其中一种).
(其中一种).