题目内容
14.用铝箔包好的2.3g钠块投入足量水中,则产生氢气的质量是( )| A. | 0.1g | B. | >0.1g | C. | <0.1g | D. | 无法确定 |
分析 金属钠可以和水反应生成氢氧化钠和氢气,铝可和反应产物氢氧化钠反应生成氢气.
解答 解:金属钠可以和水反应生成氢氧化钠和氢气,即2Na+2H2O=2NaOH+H2↑,质量为2.3g的钠放入到足量的水中,可以产生0.1g氢气,但是铝箔又可和反应产物氢氧化钠反应生成氢气,所以生成的氢气要大于钠和水反应生成的氢气.
故选B.
点评 本题考查金属钠和金属铝的化学性质,可以根据所学知识进行回答,难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
5.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA | |
| B. | 电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜 | |
| C. | 2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023 |
19.氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN 可通过反应:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.下列叙述正确的是( )
| A. | Al2O3是氧化剂 | B. | N2被氧化 | ||
| C. | AlN的摩尔质量为41 g | D. | 生成1 mol AlN转移3 mol电子 |
6.能证明SO2还原性的是( )
| A. | 品红溶液通入SO2气体后红色消失 | |
| B. | 显红色的酚酞溶液通入SO2后红色消失 | |
| C. | 酸性KMnO4溶液通入SO2后紫色消失 | |
| D. | 溴水通入SO2气体后橙色消失 |
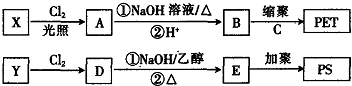
 →
→
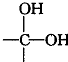
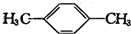 ,其核磁共振氢谱有2种峰.
,其核磁共振氢谱有2种峰. ,
, .
.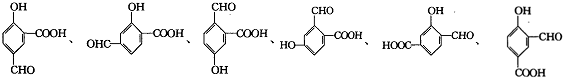 (其中一种).
(其中一种). $→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+
$→_{②Zn/H_{2}O}^{①O_{3}}$R-CHO+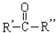
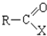 +H2O→R-COOH+HX
+H2O→R-COOH+HX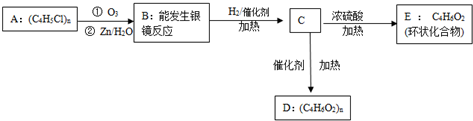
 、
、 ;
; +nH2O.
+nH2O.