题目内容
17.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) | |
| D. | 将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+) |
分析 A.由水电离出的c(H+)=1×10-amol/L,若a>7,说明该溶质抑制了水的电离,可能是酸溶液或碱溶液;
B.若溶质为硫氢化钠,HS-部分水解,溶液显示碱性,c(OH-)>c(H+),溶液中可能存在该离子浓度关系;
C.反应后溶液的pH=7,则c(OH-)=c(H+),结合电荷守恒2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+)进行判断;
D.混合液中含有离子为:OH-、A-、H+、Na+,根据混合液中的电荷守恒判断.
解答 解:A.某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,说明该溶液能抑制水的电离,可能是酸溶液或碱溶液,所以该溶液的PH值为a或14-a,故A错误;
B.若溶质为硫氢化钠,则溶液中存在的离子有S2-、HS-、OH-、Na+、H+,离子浓度为c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-),故B错误;
C.根据电荷守恒,溶液中存在:2c(R2-)+c(HR-)+c(OH-)=c(Na+)+c(H+),应溶液pH=7,则c(OH-)=c(H+),所以有2c(R2-)+c(HR-)=c(Na+),故C错误;
D.将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后,根据混合液中的电荷守恒可得:c(OH-)+c(A-)=c(H+)+c(Na+),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理及其应用、酸碱混合的定性判断、电荷守恒和物料守恒的应用等知识,注意掌握判断离子浓度大小中常用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
7.气态反应 A(g)+3B(g)═2C(g)+2D(g),在四种不同条件下的反应速率最快的是( )
| A. | v(A)=0.15 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=0.4 mol/(L•s) | D. | v(D)=0.6 mol/(L•s) |
8.300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol•L-1 Ba(OH)2溶液300mL,反应后溶液中SO42-的物质的量浓度为( )
| A. | 0.4mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.1mol•L-1 |
5.下列各组中的反应原理相同的是( )
| A. | 乙醇与浓硫酸共热140℃、170℃均能脱去水分子 | |
| B. | 甲苯、乙烯均能使酸性KMnO4溶液褪色 | |
| C. | 溴水中加入己烯或苯充分振荡,溴水层均褪色 | |
| D. | 1-溴丙烷分别与KOH水溶液、KOH乙醇溶液共热,均生成KBr |
12.下列变化属于化学变化的是( )
| A. | 碘的升华 | B. | 碘化银用于人工降雨 | ||
| C. | 液溴的气化 | D. | 漂白粉久置失效 |
2.下列化学用语使用正确的是( )
| A. | 丙烷分子的球棍模型是 | B. | 2-氯甲苯的结构简式: | ||
| C. | 乙醛分子的结构简式是CH3COH | D. | 葡萄糖、淀粉的最简式都是CH2O |
9.下列叙述错误的是( )
| A. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| B. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |
6. 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )| A. | TiCl4是还原剂 | |
| B. | 每消耗1mol Mg,Mg得到2mol电子 | |
| C. | TiCl4发生氧化反应 | |
| D. | 为防止Mg、Ti被氧化该反应可在氩气流中进行 |
9.“Cl化学”是指以碳单质或分子中含有1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的工艺,对开发新能源和控制环境污染有重要意义.
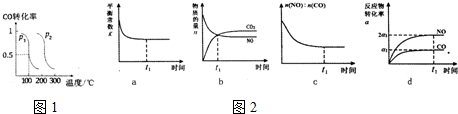
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
请回答:①c1=c2(填“>”“<”或“=”),a=19.6
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)