题目内容
14.室温下,下列各组粒子能大量共存的是( )| A. | K+、Al3+、SO42-、NH3•H2O | |
| B. | 在pH=12的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在pH=1的溶液中:K+、I-、Cl-、NO3- | |
| D. | 饱和氯水中:Cl-、NO3-、Na+、SO32 |
分析 A.铝离子与一水合氨反应生成氢氧化铝沉淀;
B.pH=12的溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与奇异果干离子反应;
C.该溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化碘离子;
D.饱和氯水具有强氧化性,能够氧化亚硫酸根离子.
解答 解:A.Al3+、NH3•H2O之间反应生成氢氧化铝,在溶液中不能大量共存,故A错误;
B.该溶液为碱性溶液,Na+、K+、AlO2-、CO32-之间不反应,都不与碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.pH=1的溶液为酸性溶液,I-、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.SO32-具有还原性,容易被饱和氯水氧化,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
4.下列物质不能用玻璃器皿贮存的是( )
| A. | 苛性钠 | B. | 氢氟酸 | C. | 浓硫酸 | D. | 硝酸铵 |
2.下列有关实验操作的说法正确的是( )
| A. | 用10mL量筒量取8.10mL稀盐酸;用托盘天平称取25.0g氯化钠 | |
| B. | 用pH计测得某溶液的pH为2.3 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
6.完全燃烧3.2g某有机物,生成8.8g 二氧化碳和7.2g 水,关于该有机物的说法正确的是( )
| A. | 只含有碳、氢两种元素,不含氧元素 | |
| B. | 肯定含碳、氢两种元素,可能含氧元素 | |
| C. | 含碳、氢两种元素,且两者的质量比为11:9 | |
| D. | 含碳、氢、氧三种元素,且三者的质量比为8:1:16 |
3.食品中常用到一些添加剂,其中NaHCO3属于( )
| A. | 氧化物 | B. | 盐 | C. | 碱 | D. | 酸 |
9.下列反应的离子方程式书写正确的是( )
| A. | 盐酸与氨水的反应:H++OH-=H2O | |
| B. | 铝与NaOH溶液的反应:Al+2OH-=AlO2-+H2↑ | |
| C. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+=2Cl-+2Fe3+ | |
| D. | 铜与稀硝酸的反应:Cu+2H++NO3-=Cu2++NO2↑+H2O |
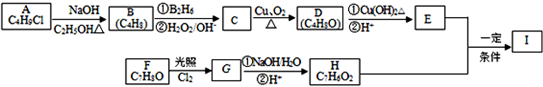
 ;
;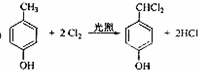 ;
; .
.