题目内容
13.关于原电池说法不正确的是( )| A. | 在铜锌原电池中Cu为正极 | |
| B. | 原电池中,化学能转变为电能 | |
| C. | 在原电池中,负极上发生氧化反应,正极上发生还原反应 | |
| D. | 在原电池中,电子从负极经过电解质溶液流向正极 |
分析 A.原电池的正极一般为不活泼的金属;
B.原电池将化学能转变为电能;
C.原电池的负极上失去电子,正极上发生还原反应;
D.原电池中电子从负极流向正极.
解答 解:A.原电池的正极一般为不活泼的金属,所以铜锌原电池中Cu为正极,故A正确;
B.原电池将化学能转变为电能,故B正确;
C.原电池的负极上失去电子,正极上发生还原反应,故C正确;
D.原电池中电子从负极流向正极,但电子不能进入溶液,故D错误;
故选D.
点评 本题考查原电池的工作原理,明确发生的电极反应及电子的流向即可解答,题目较简单.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
3.(1)将充满NO2气体的密闭烧瓶浸入冰水中,烧瓶内气体颜色变浅(填“变深”、“不变”或“变浅”),请用平衡移动原理说明变化原因2NO2?N2O4△H<0,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低;
(2)在80℃时,将0.40mol N2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如表数据:
①计算a=0.28mol,此温度时该反应的平衡常数K=1.8mol/L;
②改变条件使反应重新达到平衡,能使$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$值变小的措施有(填序号)A.
A.增大N2O4的起始浓度 B.升高温度 C.使用高效催化剂 D.向混合气体中通入稀有气体.
(2)在80℃时,将0.40mol N2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②改变条件使反应重新达到平衡,能使$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$值变小的措施有(填序号)A.
A.增大N2O4的起始浓度 B.升高温度 C.使用高效催化剂 D.向混合气体中通入稀有气体.
4.下列平衡体系中,降温、加压都使平衡向正反应移动的是( )
| A. | 2HI(g)?H2(g)+I2(g)△H<0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | C(s)+H2O(g)?CO(g)+H2(g)△H>0 | D. | CaCO3(s)?CO2(g)+CaCO3(s)△H>0 |
18.对化学基本概念的理解和把握是学好化学的关键,下列说法正确的是( )
| A. | 化学平衡常数是指在一定温度下生成物浓度幂之积与反应物浓度幂之积的比值 | |
| B. | 勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强、参与反应物质的浓度,),平衡将向着能够减弱这种改变的方向移动 | |
| C. | 盐溶液不一定呈中性,不显中性的盐都会促进水的电离 | |
| D. | 把被保护的钢铁设备作为电解池的阴极,该方法称为牺牲阳极的阴极保护法 |
2.下列说法正确的是( )
| A. | 人造纤维、合成纤维和碳纤维都是有机高分子化合物 | |
| B. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 煤的干馏和石油的分馏均属于化学变化 | |
| D. | 油脂都不能使溴的四氯化碳溶液褪色 |
3.向足量H2SO4溶液中加入100mL0.4mol•L-1Ba(OH)2溶液,放出的热量是5.12kJ,如果向足量Ba(OH)2溶液中加入100mL0.4mol•L-1盐酸时,放出的热量为2.2kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-2.92kJ•mol-1 | |
| B. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-18kJ•mol-1 | |
| C. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-73kJ•mol-1 | |
| D. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-0.72kJ•mol-1 |
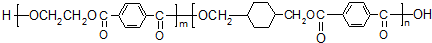
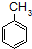 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$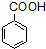
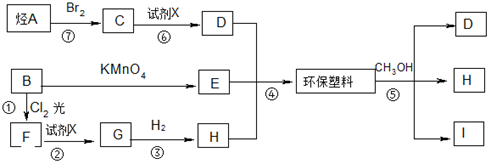
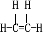 ;
;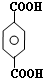 ;B的名称:对二甲苯,试剂X为NaOH水溶液.
;B的名称:对二甲苯,试剂X为NaOH水溶液.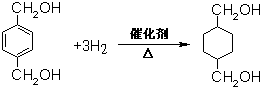 .
.
 、CH2(OH)CH2CH2CH2COOH.
、CH2(OH)CH2CH2CH2COOH.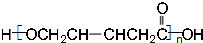 .
. +2NaOH→
+2NaOH→ +2H2O.
+2H2O.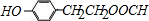 .
.