题目内容
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
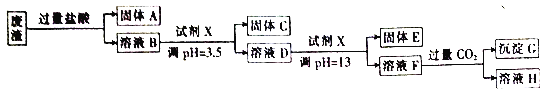
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阳离子 | Fe3+ | A13+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol/L。
请回答下列问题:
(1)固体C为________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是________(填“氨水”或“氢氧化钠”),其理由是________ 。
(3)向溶液D中滴人试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、________、________。
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________。
(5)写出溶液F→溶液H的离子方程式: ________ 。
(6)Ksp[Mg(OH)2]= ________。
【答案】 Fe(OH)3 氢氧化钠 经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=A1O2-+2H2O 镁离子沉淀不完全或氢氧化铝溶解不完全 A1O2-+CO2+2H2O=Al(OH)3↓+HCO3- 10-11
【解析】废渣中加入过量的盐酸,MgO、Al2O3、Fe2O3分别溶解生成相应的Mg2+ 、Al3+、 Fe3+,而SiO2不溶解,所以固体A为SiO2;溶液B中加入试剂X,调节pH=3.7生成固体C为氢氧化铁,溶液D中加入试剂X,调溶液pH=13,则产生氢氧化镁沉淀,说明此时铝离子应以偏铝酸根子存在,在试剂X为强碱情况下,溶液F含有偏铝酸根离子与通入足量的二氧化碳气体反应,生成氢氧化铝沉淀,溶液H中含有碳酸氢根离子。
(1)固体C应为Fe(OH)3固体;正确答案:Fe(OH)3。
(2)根据题给信息可知饱和氨水溶液中c(OH-)约为1×10-3mol/L,溶液pH=11,所以只能选择强碱溶液调节溶液调至pH=13,因此上述流程中两次使用试剂均为氢氧化钠溶液;正确答案:氢氧化钠 ;经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸碱性。
(3)D溶液中含有Mg2+、Al3+;逐滴加入氢氧化钠溶液,Al3+先与OH-反应生成Al(OH)3沉淀,然后Al(OH)3继续与过量的氢氧化钠溶液反应,生成偏铝酸根离子,沉淀溶解,离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=A1O2-+2H2O;正确答案:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=A1O2-+2H2O。
(4)溶液D(含有Mg2+、Al3+)→固体E(Mg(OH)2)的过程中需要控制溶液pH=13,如果pH过小,导致氢氧化钠溶液加的量不足,会导致镁离子沉淀不完全或氢氧化铝固体溶解不完全;正确答案:镁离子沉淀不完全或氢氧化铝溶解不完全。
(5)溶液F为偏铝酸钠溶液,通入足量的二氧化碳气体生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:A1O2-+CO2+2H2O=Al(OH)3↓+HCO3-;正确答案:A1O2-+CO2+2H2O==Al(OH)3↓+ HCO3-。
(6)根据题给信息可知:阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L),即c(Mg2+)=10-5mol/L,溶液的pH=11时,氢氧化镁沉淀完全,c(OH-)=10-3 mol/L, Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=10-5×(10-3)2=10-11;正确答案:10-11。

【题目】钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钡钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇(![]() )厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
)厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:

(1)电解食盐水时,总反应的离子方程式______________。
(2)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是________________________。
(3)已知:①![]()
![]() H=
H=![]()
②![]()
![]() H=
H=![]()
则![]()
![]() H=_____________。
H=_____________。
(4)写出钛铁矿高温下经氯化法得到四氧化钛的化学方程式:________________。
(5)某自来水中含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
物质 |
|
|
|
|
|
|
溶解度( |
|
|
|
|
| 26.7 |
①请用化学方程式表示锅炉中的水垢含有![]() 而不含有
而不含有![]() 的原因:_______。
的原因:_______。
②锅炉中的水垢所含有的![]() 不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去,
不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去, ![]() 能转化为物质Y的离子方程式_________。
能转化为物质Y的离子方程式_________。
③水中的![]() 、
、![]() 可以用一定浓度的M溶液进行测定,M与
可以用一定浓度的M溶液进行测定,M与![]() 、
、![]() 都以等物质的量进行反应,现取含
都以等物质的量进行反应,现取含![]() 浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中
浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中![]() 的物质的量浓度是________。
的物质的量浓度是________。
