题目内容
【题目】在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中,下列说法正确的是
A. 氧化产物与还原产物物质的量之比5∶2
B. 2mol KMnO4完全反应,转移的电子数为16NA
C. 该反应中HCl做还原剂,KCl、MnCl2是氧化产物
D. 氧化剂与还原剂的物质的量之比5∶1
【答案】A
【解析】
A.在2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化产物是Cl2,还原产物是MnCl2,所以氧化产物与还原产物物质的量之比5∶2,故A正确;
B.反应中Mn的化合价由+7![]() +2,2mol KMnO4完全反应,转移的电子数为10NA,故B错误;
+2,2mol KMnO4完全反应,转移的电子数为10NA,故B错误;
C.该反应中HCl做还原剂,Cl2是氧化产物,故C错误;
D.KMnO4氧化剂,HCl是还原剂,物质的量之比为1:5,故D错误;
本题答案为A。

【题目】已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在________(填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是______(填序号)。
①100mL容量瓶②烧杯③滴定管夹④漏斗⑤玻璃棒⑥托盘天平
(3)到达滴定终点的标志是____________________________________________。
(4)根据上述数据计算X=________________。
(5)误差分析(填偏高、偏低或无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;
②若KMnO4标准溶液浓度偏低,则X值_________;
③若锥形瓶洗净后瓶内还残留有少量蒸馏水,则X值____________。
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据下列能量变化示意图,请写出![]() 和CO反应的热化学方程式______。
和CO反应的热化学方程式______。

(2)在固定体积的密闭容器中,进行如下化学反应: ![]()
![]() H<0,其平衡常数K与温度T的关系如下表:
H<0,其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K |
|
|
|
①试判断![]() ______
______![]() (填写>、=,<)
(填写>、=,<)
②下列各项能说明该反应已达到平衡状态的是_______(填字母)
a. 容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2
b. ![]()
c. 容器内压强保持不变
d. 混合气体的密度保持不变
(3)对反应![]()
![]() H>0,在温度分别为
H>0,在温度分别为![]() 、
、![]() 时,平衡体系中
时,平衡体系中![]() 的体积分数随压强变化曲线如下图所示。
的体积分数随压强变化曲线如下图所示。

①A、C两点的反应速率:A_________C(填>、=、<)
②A、C两点![]() 的转化率:A_________C(填>、=、<)
的转化率:A_________C(填>、=、<)
③由状态B到状态A,可以采用的方法是__________。
(4)一定温度下
①若在1L的密闭容器中,充入1 mol![]() 和3 mol
和3 mol![]() 发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则
发生反应,并维持容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则![]() 的转化率a(
的转化率a(![]() )=______,以
)=______,以![]() 表示该过程的反应速率v(
表示该过程的反应速率v(![]() )=_________.
)=_________.
②若在1L的密闭容器中,充入2mol![]() 和6mol
和6mol![]() 发生反应,并维持压强恒定,达到平衡时,
发生反应,并维持压强恒定,达到平衡时, ![]() 平衡浓度比①中
平衡浓度比①中![]() 平衡浓度的2倍________。(填>、=、<)
平衡浓度的2倍________。(填>、=、<)
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
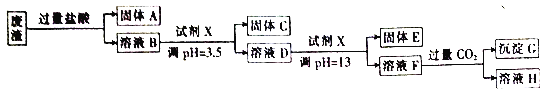
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阳离子 | Fe3+ | A13+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol/L。
请回答下列问题:
(1)固体C为________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是________(填“氨水”或“氢氧化钠”),其理由是________ 。
(3)向溶液D中滴人试剂X的过程中,发生反应的离子方程式有Mg2++2OH-=Mg(OH)2、________、________。
(4)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________。
(5)写出溶液F→溶液H的离子方程式: ________ 。
(6)Ksp[Mg(OH)2]= ________。
