题目内容
12.含氮化合物是重要的化工原料.存在如下转化关系:
(1)工业上常用浓氨水检验氯气管道是否泄漏.
①氨气溶于水的过程中存在的平衡有(用离子方程式表示)NH3+H2O?NH3?H2O?NH4++OH-.
②向固体氧化钙中滴加浓氨水,可用于实验室制取少量氨气,简述原理氧化钙与水反应放热,生成氢氧化钙溶于水增大了OH-离子浓度,氨水中的离子平衡向左移动,使氨气挥发出来.
(2)转化Ⅱ中发生的系列反应,在工业上可以用来制备硝酸,写出①中反应的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
(3)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱.转化Ⅲ中部分反应如下:
NH3+CO2+H2O═NH4HCO3,NH4HCO3+NaCl(饱和)═NaHCO3↓+NH4Cl.
①转化Ⅲ中有NaHCO3沉淀析出的原因是混合液中NaHCO3的溶解度最小,溶液达过饱和时会有NaHCO3晶体析出.
②欲测定某工业纯碱样品中Na2CO3的质量分数,某同学设计方案如下:
准确称取10.00g样品,加入过量的盐酸,充分反应,蒸干、冷却后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.样品中碳酸钠的质量分数为95.4%.
(4)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点.工作原理如图2所示:
①固体氧化物作为电池工作的电解质,O2-移向(填字母)A.
A.电极a B.电极b
②该电池工作时,电极a上发生的电极反应为2NH3+3O 2--6e-=N2+3H2O.
分析 (1)①氨气溶于水与水反应生成一水合氨,一水合氨电离形成铵根和氢氧根离子,据此书写;
②根据氧化钙与水反应放热,促进氨水中的离子平衡向左移动,使氨气挥发出来;
(2)氨气发生催化氧化生成一氧化氮和水;
(3)①根据NaHCO3的溶解度最小,溶液达过饱和时会有NaHCO3晶体析出分析;
②根据Na2CO3+2HCl═2NaCl+CO2↑+H2O进行计算;
(4)根据无污染的特点可知反应为2NH3+3O2=N2+6H2O,通入氨气的一极为负极,阴离子向负极移动;负极发生氧化反应,氨气被氧化生成氮气.
解答 解:(1)①氨气溶于水与水反应生成一水合氨,一水合氨电离形成铵根和氢氧根离子,电离方程式为NH3+H2O?NH3?H2O?NH4++OH-,故答案为:NH3+H2O?NH3?H2O?NH4++OH-;
②向固体氧化钙中滴加浓氨水,因为氧化钙与水反应放热,促进氨水中的离子平衡向左移动,使氨气挥发出来,故答案为:氧化钙与水反应放热,生成氢氧化钙溶于水增大了OH-离子浓度,氨水中的离子平衡向左移动,使氨气挥发出来;
(2)氨气发生催化氧化生成一氧化氮和水,方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(3)①因为NaHCO3的溶解度最小,所以溶液达过饱和时会有NaHCO3晶体析出,故答案为:混合液中NaHCO3的溶解度最小,溶液达过饱和时会有NaHCO3晶体析出;
②设10.00g样品中含碳酸钠为xg,则
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 2×58.5
x 10.99
所以$\frac{106}{x}$=$\frac{2×58.5}{10.99}$,解得x=9.96g,则样品中碳酸钠的质量分数为$\frac{9.96}{10}$×100%=99.6%,故答案为:99.6%;
(4)①通入氨气的一极为负极,阴离子向负极移动,即由电极b向电极a移动,故选:A;
②在a上发生的反应为负极反应,氨气被氧化生成氮气,电极方程式为2NH3+3O 2--6e-=N2+3H2O,故答案为:2NH3+3O2--6e-=N2+3H2O.
点评 本题考查较为综合,涉及氨水的电离平衡,纯碱的制备原理以及电化学知识,综合考查学生的分析能力和计算能力,为高考高频考点和常见题型,难度中等,注意电极方程式的书写.

| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 已知单质A能从溶液中置换出单质B,当A为非金属时,B也一定是非金属 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
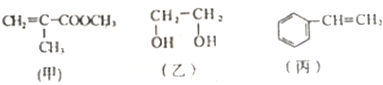
| A. | 甲物质可以在引发剂作用下生成有机高分子化合物 | |
| B. | 甲、乙、丙三种物质都可以发生加成反应 | |
| C. | 丙物质能够使酸性高锰酸钾溶液褪色 | |
| D. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 |
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 向明矾溶液中加过量氢氧化钠溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| A. | ${\;}_{55}^{133}Cs$和${\;}_{55}^{137}Cs$互为同位素 | |
| B. | ${\;}_{67}^{166}Ho$的原子核内的中子数与核外电子数之差为32 | |
| C. | 元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 | |
| D. | 1 mol KHSO4加热熔化可电离出2NA个阳离子 |
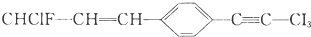 关于该分子结构的说法正确的是( )
关于该分子结构的说法正确的是( )| A. | 除苯环外的其余碳原子有可能都在一条直线上 | |
| B. | 除苯环外的其余碳原子不可能都在一条直线上 | |
| C. | 12个碳原子不可能都在同一平面上 | |
| D. | 12个碳原子一定都在同一平面上 |
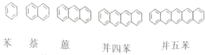
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
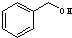 与
与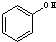 ⑥
⑥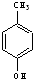 与
与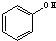
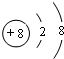 ,D元素在周期表中的位置是第三周期ⅥA族.
,D元素在周期表中的位置是第三周期ⅥA族.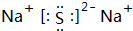 ,氢化物的稳定性是A>D(填“>”或“<”).
,氢化物的稳定性是A>D(填“>”或“<”).