题目内容
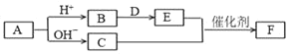
【题目】磁性材料A是一种二元化合物,某研究小组按如图流程探究其组成,已知E是一种能够漂白品红的气体,亦能使酸性KMnO4溶液褪色。请回答:

(1)某同学取少量溶液C于一支试管,加入______(填化学式)试剂无现象,可证明固体B无杂质。
(2)A的化学式为:______。
(3)溶液C可溶解铜片,若反应过程中C中某离子浓度变化如图中①所示,请写出用铜离子表达的0~t1阶段的化学反应速率:v(Cu2+)=______;相对①,②可能改变的实验条件是______。

(4)已知![]() 的KI溶液中存在平衡I2+I-
的KI溶液中存在平衡I2+I-![]() I3-,该平衡常数K的表达式为:______,在
I3-,该平衡常数K的表达式为:______,在![]() 的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
的CCl4溶液中加入KI溶液,振荡、静置后可以观察到的现象是:______。
(5)F是一种二元酸H2M(M代表酸根)的溶液。T℃时,向某浓度的H2M溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2M、HM-、M2-的物质的量分数(![]() )与pH的关系如图所示:
)与pH的关系如图所示:

①若H2M的电离常数分别为K1与K2,则![]() ______。
______。
②按投料比n(Na2M):n(NaHM)=2:1配成溶液,下列有关该溶液的叙述正确的是______(填序号)。
A.该溶液的pH为=7.0
B.3c(Na+)+c(H+)=c(OH-)+c(HM-)+2c(M2-)
C.3c(Na+)=5[c(HM-)+c(M2-)+c(H2M)]
D.3c(OH-)+ c(M2-)=3c(H+)+2c(HM-)+5c(H2M)
(6)若F与I2的KI溶液恰好完全反应,写出反应的化学方程式______;在反应后的溶液加入足量AgNO3溶液充分反应,测得混合体系中c(I-)=amol/L,则c(SO42-)=______mol/L(已知25℃时,Ksp(AgI)=8.3×10-17,Ksp(Ag2SO4)=1.4×10-5)。
【答案】K3[Fe(CN)6] Fe3S4 ![]() mol/(L·min) 加水稀释 K=
mol/(L·min) 加水稀释 K= 溶液颜色变浅 105.2 CD H2SO3+I2+H2O=2HI+H2SO4 2.0×1027a2
溶液颜色变浅 105.2 CD H2SO3+I2+H2O=2HI+H2SO4 2.0×1027a2
【解析】
(1)(2)二元化合物A充分煅烧产生的红棕色固体化合物B是Fe2O3,加入盐酸反应产生的C是FeCl3,加入KSCN溶液,产生红色物质Fe(SCN)3,说明A中有Fe元素;煅烧产生的无色气体E是一种能够漂白品红的气体,亦能使酸性KMnO4溶液褪色,说明E是SO2,SO2溶于水反应产生的F是H2SO3,H2SO3与I2水溶液反应产生H2SO4和HI,说明A中含有S元素,根据元素守恒,结合A、B质量可得A的化学式;
(3)Cu和溶液C反应实质为2Fe3++Cu=2Fe2++Cu2+,根据化学反应速率定义式及微粒间反应转化关系计算v(Cu2+);根据相同时间内物质的浓度改变数值大小比较①、②的反应速率;
(4)利用平衡常数表达式书写该平衡常数K的表达式;利用平衡移动原理判断平衡移动方向;
(5)①若H2M的电离常数分别为 K1 与 K2,利用c(HM-)=c(H2M)时,计算K1,c(HM-)=c(M2-),计算K2;
②按投料比n(Na2M):n(NaHM) =2:1配成溶液,根据物质的电离、水解程度大小及物料守恒、质子守恒、电荷守恒,比较微粒浓度大小关系;
(6)F为H2SO3,若F与I2的KI溶液恰好完全反应,二者发生氧化还原反应生成硫酸、HI。利用溶度积常数,计算有关微粒的浓度。
根据上述分析可A为Fe、S两种元素的化合物,B为Fe2O3,C为FeCl3;D为Fe(SCN)3,E是SO2,F为 H2SO3,G为H2SO4、HI的混合物。
(1)根据上述分析可知C为FeCl3溶液,向C加入KSCN溶液,产生血红色溶液,D为Fe(SCN)3,若B中含有杂质,则生成的C中含有Fe2+,Fe2+能与铁氰化钾溶液反应产生蓝色沉淀,所以加入的检验试剂为K3[Fe(CN)6];
(2)B为Fe2O3,且n(Fe2O3)= 2.400g÷160g/mol=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,根据上述分析可知A是Fe、S两种元素的化合物,A的质量是2.960g,则m(S)=2.960g-1.68g=1.28g,n(S)=1.28g÷32g/mol=0.04mol,则n(Fe):n(S)= 0.03mol:0.04mol =3:4,所以A化学式为Fe3S4;
(3)Cu和溶液C反应实质为2Fe3++Cu=2Fe2++Cu2+,根据图知,浓度减小的应该是Fe3+,化学反应速率v(Cu2+)=![]() v(Fe3+)=
v(Fe3+)=![]() ×
×![]() mol/(L·min)=
mol/(L·min)=![]() mol/(L·min);
mol/(L·min);
根据图示可知:相对①,②减小相同浓度,需要的反应时间更长,说明其反应速率减小,改变的条件可能是加水稀释;
(4)根据平衡常数的含义,可知反应I2+I-![]() I3-的平衡常数K的表达式为K=
I3-的平衡常数K的表达式为K= ,在I2的CCl4溶液中加入KI溶液,振荡、静置后,平衡正向移动,可以观察到溶液颜色变浅;
,在I2的CCl4溶液中加入KI溶液,振荡、静置后,平衡正向移动,可以观察到溶液颜色变浅;
(5)①若H2M的电离常数分别为K1与K2,当c(HM-)=c(H2M)时,K1= =c(H+)=10-1.8;
=c(H+)=10-1.8;
当c(HM-)=c(M2-),K2= = c(H+)=10-7.0;则
= c(H+)=10-7.0;则![]() =105.2;
=105.2;
②按投料比n(Na2M):n(NaHM) =2:1配成溶液,
A.Na2M水解程度大于NaHM电离程度,则c(Na2M)<c(NaHM),根据图知,该溶液的pH 小于7.0,A错误;
B.溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HM-)+2c(M2-),B错误;
C.溶液中存在物料守恒3c(Na+)=5[c(HM-)+c(M2-)+c(H2M)],C正确;
D.溶液中存在电荷守恒①c(Na+)+c(H+)=c(OH-)+c(HM-)+2c(M2-),溶液中存在物料守恒②3c(Na+)=5[c(HM-)+c(M2-)+c(H2M)],将①带入②式,整理可得3c(OH-)+c(M2-)=3c(H+)+2c(HM-)+5c(H2M),D正确;
故合理选项是CD;
(6)F为H2SO3,若F与I2的KI溶液恰好完全反应,二者发生氧化还原反应生成硫酸、HI,反应方程式为H2SO3+I2+H2O=2HI+H2SO4,测得混合体系中 c(I-)=amol/L,则溶液中c(Ag+)= mol/L,则c(SO42-)=
mol/L,则c(SO42-)= =2.0×1027a2mol/L。
=2.0×1027a2mol/L。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案