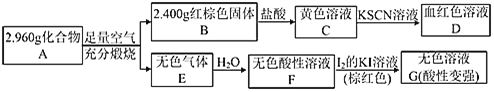
题目内容
【题目】Q、X、Y、Z、W五种元素的原子序数依次增大,Y、Z、W的核外电子数成等差数列。已知:①Q原子的最外层电子数是次外层电子数的2倍;②Y、Z同主族,Y原子的价电子排布图为![]() 。
。
请回答下列问题:
(1)基态Q原子中,核外电子共占据了________个轨道,电子占据的最高能级符号为________,该能级被电子填满时还需要________个电子。
(2)W的元素名称为________,其基态原子的电子排布式为________。
(3)Y分别与Q、Z形成的两种三原子分子的立体构型分别为________、________;对应的中心原子的杂化类型为________、________。
(4)Q、X、Y三种元素的第一电离能按由大到小的顺序是________(填元素符号,下同),电负性由大到小的顺序为________。
【答案】4 2p 4 铬 [Ar]3d54s1或1s22s22p63s23p63d54s1 直线型 V型 sp sp2 N>O>C O>N>C
【解析】
Q、X、Y、Z、W五种元素的原子序数依次增大,Q原子的最外层电子数是次外层电子数的2倍,则Q是碳(C);Y原子的价电子排布图为![]() ,则Y是氧(O);又Y、Z同族,则Z是硫(S);X是氮(N),Y、Z、W的核外电子数成等差数列,则W是24号元素铬(Cr)。
,则Y是氧(O);又Y、Z同族,则Z是硫(S);X是氮(N),Y、Z、W的核外电子数成等差数列,则W是24号元素铬(Cr)。
(1)基态C原子的核外电子排布式为1s2s22p2,2p能级占据两个轨道,共占据4个轨道;最高能级符号是2p;2p能级全部填满还需4个电子;
(2)W是24号铬元素;基态电子排布遵循能量最低原理,故核外电子排布式为:[Ar]3d54s1或1s22s22p63s23p63d54s1;
(3)氧和碳形成三原子分子CO2,采取sp杂化,呈直线型;氧和硫形成三原子分子SO2,采取sp2杂化,含一对孤对电子,呈V型;
(4)第一电离能指气态中性原子失去最外层一个电子变成气态离子所需要的能量,N元素2p能级半满,较稳定,大于O元素,故第一电离能按由大到小的顺序是N>O>C;电负性是指原子对电子的吸引能力,C、N、O三者电负性由大到小的顺序为O>N>C。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案