题目内容
11.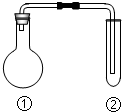 下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )
下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )| ①中的反应 | ②中的现象 | 结论 | |
| A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
| B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
| C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化锰与浓盐酸在加热条件下反应生成氯气,氯气能够氧化碘离子生成单质碘;
B.二氧化硫与溴水发生氧化还原反应,使溴水褪色;
C.醋酸易挥发,进入②中的气体可能为醋酸与二氧化碳的混合气体;
D.制乙炔气体时用的是电石,电石主要成分是CaC2 还有杂质CaS Ca3P2等,这些杂质CaS Ca3P2也能和水反应,生成H2S,PH3等杂质,对实验造成干扰.
解答 解:A.二氧化锰与浓盐酸在加热条件下反应生成氯气,氯气能够氧化碘离子生成单质碘,碘与到淀粉变蓝,故A正确;
B.二氧化硫与溴水发生氧化还原反应,使溴水褪色,体现二氧化硫还原性,与二氧化硫的漂白性无关,故B错误;
C.醋酸易挥发,进入②中的气体可能为醋酸与二氧化碳的混合气体,苯酚钠变浑浊,可能是碳酸与苯酚钠反应生成苯酚,也可能是醋酸与苯酚钠反应生成苯酚,不能得出结论酸性:碳酸>苯酚,故C错误;
D.电石与饱和食盐水反应除了生成乙炔外还含有杂质气体硫化氢等,硫化氢也具有还原性,能够使酸性高锰酸钾溶液褪色,乙炔和硫化氢都具有还原性,结论不严密,故D错误;
故选:A.
点评 本题考查气体的制备及物质的性质,明确实验过程和各物质的性质是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.部分弱电解质的电离平衡常数如下表.
下列说法不正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 在25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(NH4+)=c(SO42-) | |
| D. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
16.化学与科技、社会、生活密切相关,下列说法不正确的是( )
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
3.下列离子反应方程式错误的是( )
| A. | 向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 稀Fe(NO3)2溶液中加入稀盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+2H2O |
20.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 反应KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为6NA | |
| B. | 标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
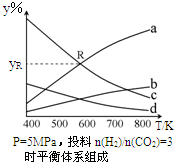 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.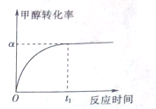 乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:
乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题: