题目内容
2.部分弱电解质的电离平衡常数如下表.| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 在25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(NH4+)=c(SO42-) | |
| D. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
分析 A.酸的电离平衡常数越大,酸的电离程度越大,则酸根离子结合氢离子能力越小;
B.HCOOH的电离平衡常数大于NH3•H2O,则NH4+水解程度大于HCOO-,据此判断溶液酸碱性及离子浓度大小;
C、根据电解质中的电荷守恒判断;
D、0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液,发生反应后,得到碳酸钠和碳酸氢钠的混合液,溶液中存在电荷守恒,据此回答.
解答 解:A.酸的电离平衡常数越大,酸的电离程度越大,则酸根离子结合氢离子能力越小,所以酸根离子结合氢离子能力大小顺序是CO32->CN->HCO3->HCOO-,故A正确;
B.HCOOH的电离平衡常数大于NH3•H2O,则NH4+水解程度大于HCOO-,所以HCOONH4溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(HCOO-)>c(NH4+),盐溶液中氢离子浓度很小,所以离子浓度大小顺序是c(HCOO-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C、将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,混合溶液呈中性,所以c(H+)=c(OH-),根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+2c(SO42-),所以c(NH4+)=2c(SO42-),故C错误;
D、0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液,发生反应后,得到碳酸钠和碳酸氢钠的混合液,溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),故D错误.
故选CD.
点评 本题考查了弱电解质的电离,根据电离平衡常数、酸根离子水解程度之间的关系来分析解答,灵活运用守恒思想分析,易错选项是D,根据阳离子比较离子总数即可,为易错点.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | 无色透明的溶液中:Cl-,Br-,Na+,Cu2+ | |
| B. | 含有大量ClO-的溶液中:SO42-,Cu2+,I-,Fe2+ | |
| C. | 使pH试纸变蓝的溶液中:CO32-,Cl-,F-,K+ | |
| D. | 水电离出c(H+)=1×10-12的溶液中:Ca2+,HCO3-,Mg2+,NO3- |
| A. | NH4+,Ag+,NO3-,CO32-,SO42- | B. | Fe2+,H+,NO3-,Cl- | ||
| C. | Al3+、NH4+,HCO3-、Cl- | D. | K+、Na+、NO3-、SO42- |
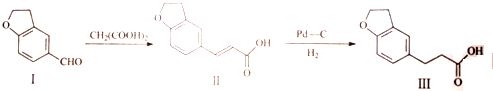
| A. | 可用浓溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1mol化合物Ⅰ最多能与3molH2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子含有2个醛基的芳香族化合物有10种 |
| A. | 若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 | |
| B. | 若M属于离子化合物,则该化合物中只存在离子键,且每个原子均达到8电子稳定结构 | |
| C. | 若最外层电子数X>Y>2,则X的非金属性一定比Y的非金属性强 | |
| D. | 若X和Y处于同一周期,且M属于共价化合物,则分子中原子个数比可能为1:2 |
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | Y属于不饱和烃 | |
| D. | Y的二氯代物有三种 |
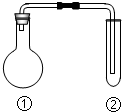 下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )
下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)( )| ①中的反应 | ②中的现象 | 结论 | |
| A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
| B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
| C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 通入足量SO2:Na+、S2-、OH-、AlO2- | B. | 通入足量CO2:K+、Ca2+、Cl-、NO3- | ||
| C. | 通入足量Cl2:SO2、Ba2+、Cl-、K+ | D. | 通入足量NH3:Fe3+、Cl-、Ba2+、Al3+ |
 .
.