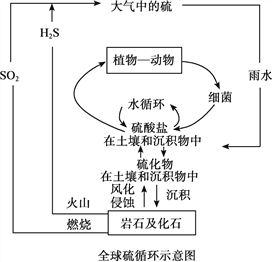
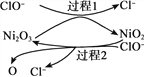
��Ŀ����
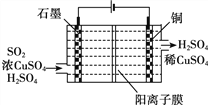
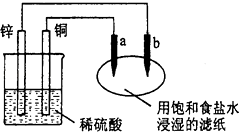
����Ŀ���ö��Ե缫���һ����������ͭ��Һ��ʵ��װ������ͼ�ס��������е�ʵ����������ͼ�ң��������ʾ��������ת�Ƶ��ӵ����ʵ������������ʾ�������в������������ ��(��״��)��������˵������ȷ����
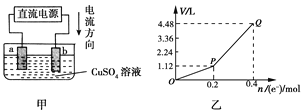
A. �������У�a�缫�������к�ɫ�����������������ݲ���
B. b�缫�Ϸ�����Ӧ�ķ���ʽΪ��4OH����4e��=2H2O��O2��
C. ����O��P�α�ʾO2������仯
D. �ӿ�ʼ��Q��ʱ�ռ����Ļ�������ƽ��Ħ������Ϊ12 g/mol
���𰸡�D
����������ͼ��֪��������������������bΪ������aΪ���������Ե缫���һ����������ͭ��Һ������2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4�����ͼ2��֪��ͨ��0.2mol����ʱ�������ͭ��Ȼ����������Һ������2H2O
2Cu+O2��+2H2SO4�����ͼ2��֪��ͨ��0.2mol����ʱ�������ͭ��Ȼ����������Һ������2H2O![]() 2H2��+O2����
2H2��+O2����
A��aΪ�������ȷ���Cu2++2e���TCu������2H++2e���TH2����a�缫�������к�ɫ�����������������ݲ�������A��ȷ��
B��bΪ��������Һ�е����������ӷŵ磬��b�缫�Ϸ����ķ�Ӧ����ʽΪ��4OH����4e���TH2O+O2����B��ȷ��
C��������������֪������0��P�α�ʾO2������仯������P��Q�α�ʾH2��O2������������仯����C��ȷ��
D������0��P�α�ʾO2������仯��P��1.12LΪO2�������ʵ���Ϊ0.05mol��PQ��3.36L�����У��ɵ��ˮ��Ӧ��֪0.2mol����ͨ��ʱ����0.1mol H2��0.05mol O2����ӿ�ʼ��Q���ռ����Ļ��������O2Ϊ0.1mol��HΪ0.1mol���ʻ�������ƽ��Ħ������Ϊ![]() =17gmol��1����D����ѡ��D��
=17gmol��1����D����ѡ��D��

 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�����Ŀ���ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У� ��CH4��g��+H2O��g��CO��g��+3H2��g����H1=206.1kJmol��1
��CH4��g��+CO2��g��2CO��g��+2H2��g����H2=247.3kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H3
��ش��������⣺
��1����һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5min�ڣ�v��H2��=��10minʱ���ı��������������� �� 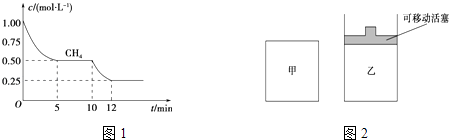
��2����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2 �� ʹ�ס�����������ʼ�ݻ���ȣ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䣮 �ٿ����жϼ������з�Ӧ�Ѵ�ƽ��״̬���� ��
a������CH4������������CO�����ʵ�2��
b��������ѹǿ���ֲ���
c��������������ܶȱ��ֲ���
d�������ڸ������Ũ�ȱ��ֲ���
�ڼ����������з�Ӧ�ﵽƽ��ʱ������˵����ȷ���� ��
a����ѧ��Ӧ���ʣ�v ���ף���v ���ң�
b�������ת���ʣ������ף��������ң�
c��ѹǿ��P���ף�=P ���ң�
��3����Ӧ���С�H3= kJmol��1 �� 800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ����������
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵ��������ţ���
a��v��������v ���棩 b��v��������v���棩 c��v������=v���棩 d�����жϣ�
����Ŀ������һƿA��B�Ļ��Һ����֪���ǵ����������
���� | �۵�/�� | �е�/�� | �ܶ�/gcm��3 | �ܽ��� |
A | ��11.5 | 198 | 1.11 | A��B���ܣ��Ҿ�������ˮ |
B | 17.9 | 290 | 1.26 |
�ݴ˷�������A��B����ij��÷����ǣ� ��
A.����
B.��Һ
C.����
D.����