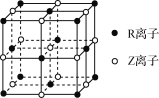
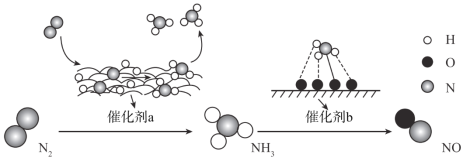
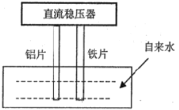
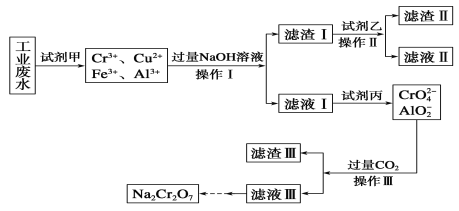
题目内容
【题目】在一定条件下![]() 与
与![]() 发生反应:
发生反应:![]() ,则下列关于元素M的叙述正确的是
,则下列关于元素M的叙述正确的是
A.M位于元素周期表中第VA族
B.M的氢化物的水溶液显酸性
C.![]() 中M元素只能被还原
中M元素只能被还原
D.![]() 在常温常压下一定是气体
在常温常压下一定是气体
【答案】B
【解析】
由反应方程式可知,M的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价;则M为卤族元素但F元素除外,处于中间价态的元素具有氧化性和还原性,常温常压下,氯气是气体、溴是液体、碘是固体,据此分析解答。
A.由上述分析可知,M位于元素周期表中VIIA族,故A错误;
B.F元素没有正化合价,所以M不能为F元素,可以为Cl、Br、I等,其氢化物HX水溶液均显酸性,故B正确;
C.M的最低负价为1,M最高正价为+7价,![]() 中M为+5价,处于中间价态,既具有氧化性又具有还原性,故C错误;
中M为+5价,处于中间价态,既具有氧化性又具有还原性,故C错误;
D.若M为Cl,单质为气体,若M为I或Br也可以发生如上反应,碘为固体,溴为液体,故D错误;
故答案为:B。

【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
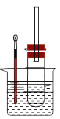
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
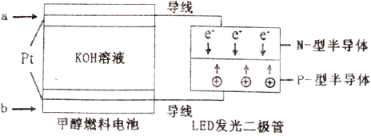
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。