题目内容
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大。五种元素中,仅R为金属元素,其原子序数为27。X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个。根据判断出的元素回答下列问题:
(1)R2+离子核外电子排布式为________,X、Y、Z三种原子第一电离能由小到大的顺序为________(用具体元素符号表示)。
(2)1 mol配合物[R(XY)6]4-中含有σ键的数目为________。
(3)XZW2是一种高毒类物质,结构与甲醛(HCHO)相似,其沸点高于甲醛的主要原因是________。
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为________(用文字描述)。
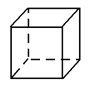
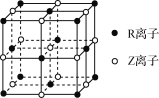
(5)某晶体的晶胞结构如图所示,则该化合物的化学式为________(R、Z用具体元素符号表示)。
【答案】1s22s22p63s23p63d7(或[Ar]3d7) C<O<N 12NA(或12×6.02×1023) 由于COCl2的相对分子质量比甲醛大,则范德华力比甲醛大,导致其沸点高于甲醛 三角锥形 CoO
【解析】
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大,五种元素中,仅R为金属元素,其原子序数为27,则R为Co元素;X价电子排布式为nsnnpn,n=2,则X的价电子排布式为2s22p2,X为C元素;元素Z基态原子s电子总数与p电子总数相等,则Z的电子排布式只能为1s22s22p2,为O元素;结合Y的原子序数可知Y为N元素;W与其它四种元素能层数不同,且未成对电子数目为1个,W只能位于第三周期,为Cl元素,据此进行解答。
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大,五种元素中,仅R为金属元素,其原子序数为27,则R为Co元素;X价电子排布式为nsnnpn,n=2,则X的价电子排布式为2s22p2,X为C元素;元素Z基态原子s电子总数与p电子总数相等,则Z的电子排布式只能为1s22s22p2,为O元素;结合Y的原子序数可知Y为N元素;W与其它四种元素能层数不同,且未成对电子数目为1个,W只能位于第三周期,为Cl元素;
(1)R的原子序数为27,R2+离子原子核外电子总数为25,其核外电子排布式为:1s22s22p63s23p63d7或[Ar]3d7;同一周期元素,元素的第一电离能随着原子序数增大呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能由小到大的顺序为:C<O<N;
(2)[R(XY)6]4-为[Co(CN)6]4,[Co(CN)6]4中CN与Co之间有6个配位键,配位键属于σ键,在每个CN内部有一个σ键,所以1mol该配合物中含有σ键的数目为12NA(或12×6.02×1023);
(3)XZW2为COCl2,与甲醛结构相似,由于COCl2的相对分子质量比甲醛大,则范德华力比甲醛大,导致其沸点高于甲醛;
(4)NCl3的分子中N原子形成3个NCl键,N原子上有1对孤电子对,故其立体构型为三角锥形;
(5)R为Co、Z为O,根据均摊法可知,在这个晶胞中氧离子位于棱上和体心,数目=12×![]() +1=4,钴离子位于顶点、面心,数目=8×
+1=4,钴离子位于顶点、面心,数目=8×![]() +6×
+6×![]() =4,所以氧离子、钴离子个数比是1:1,其化学式为:CoO。
=4,所以氧离子、钴离子个数比是1:1,其化学式为:CoO。