题目内容
【题目】电镀含铬废水的处理方法较多。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:
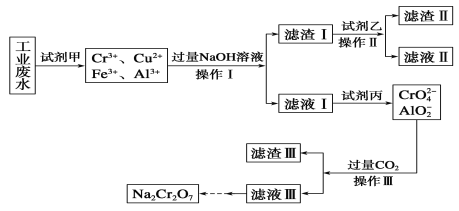
已知:a.Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7
b.Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作Ⅰ的名称为__,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有__。
(2)试剂乙的名称为__,滤渣Ⅱ的主要成分为__(写化学式)。
Ⅱ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,工业上常用还原沉淀法进行处理。
该处理方法的工艺流程为:CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处于强酸性环境中,则溶液显___色。
(2)能说明第①步反应达平衡状态的是___。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
【答案】过滤 玻璃棒 氨水 Fe(OH)3 橙 C
【解析】
I.(1)由操作流程图可知,操作Ⅰ是分离难溶性固体和液体的方法,故该操作名称为:过滤;操作I、II、III均是过滤的操作,过滤实验操作所需要的主要玻璃仪器有烧杯、漏斗、玻璃棒;
答案为过滤;玻璃棒。
(2)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,再根据题意信息Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O,所以试剂乙可以将氢氧化铜沉淀溶解掉,应为氨水,而滤渣Ⅱ为Fe(OH)3;
答案为氨水;Fe(OH)3。
II.(1)若该平衡处于强酸性环境中,平衡2CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O正向移动,所以溶液呈橙色;
答案为橙色。
(2)能说明第①步反应达平衡状态
A.两者浓度应不变,而不是相等,故A错误;
B.速率未体现正与逆的关系,故B错误;
C.平衡时各物质的浓度不再改变,即溶液的颜色不再改变,故C正确;
答案为C。

 名校课堂系列答案
名校课堂系列答案