题目内容
【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
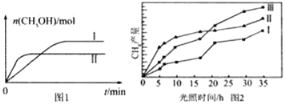
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
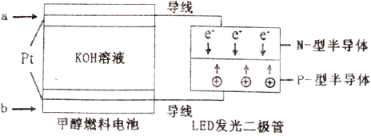
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。
【答案】 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH= -28.5kJ·mol-1 CO+4OH--2e-=CO32-+2H2O > 0.4<n(c)≤1mol Ⅱ>Ⅲ>I O2+4e-+2H2O=4OH- 1.2NA或1.2mol
2Fe(s)+3CO2(g) ΔH= -28.5kJ·mol-1 CO+4OH--2e-=CO32-+2H2O > 0.4<n(c)≤1mol Ⅱ>Ⅲ>I O2+4e-+2H2O=4OH- 1.2NA或1.2mol ![]()
【解析】(1)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
(2)CO燃料电池中,负极上是CO发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,据此书写电极反应式;
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,根据K=![]() 分析判断;②根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围;
分析判断;②根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围;
(4)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小,据此分析解答;
(5)根据电子移动的分析判断出正负极,负极上甲醇失去电子发生氧化反应,正极上氧气得到电子发生还原反应;根据电子与甲醇的物质的量关系计算;
(6)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,根据醋酸电离平衡常数K=![]() 计算。
计算。
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol;②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol;由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
(2)CO燃料电池中,负极上是CO发生失电子的氧化反应,电极反应式为:CO+4OH--2e-=CO32-+2H2O,正极上是氧气发生得电子的还原反应,电极反应式为:O2+4e-+2H2O=4OH-,故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)①平衡时,Ⅱ比Ⅰ的甲醇的物质的量少,则二氧化碳和氢气的物质的量越多,根据K=![]() 知,平衡常数越小,故KⅠ>KⅡ,故答案为:>;
知,平衡常数越小,故KⅠ>KⅡ,故答案为:>;
② CO2(g)+3H2(g)CH3OH(g)+H2O(g)
初始(mol) 1 3 0 0
平衡(mol) 1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即![]() =0.8,解得x=0.4mol,依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,故答案为:0.4<n(c)≤1mol;
=0.8,解得x=0.4mol,依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,故答案为:0.4<n(c)≤1mol;
(4)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅲ)<△n(Ⅱ),故在0~15h内,CH4的平均生成速率v(Ⅱ)>v(Ⅲ)>v(Ⅰ);故答案为:II>III>I;
(5)根据图示可知,电子由a电极经导线流向b电极,因此a为负极,b为正极,该电池负极是甲醇失电子生成碳酸钾,正极上是空气中的氧气得到电子生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-;每消耗6.4g 甲醇的物质的量=![]() =0.2mol,反应中甲醇中的碳元素由-2价变成+4价,转移电子的物质的量为1.2mol,故答案为:O
=0.2mol,反应中甲醇中的碳元素由-2价变成+4价,转移电子的物质的量为1.2mol,故答案为:O
(6)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案