题目内容
9.如图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )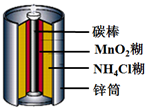
| A. | 电池负极反应为:Zn-2e-═Zn2+ | B. | 锌是负极,碳棒是正极 | ||
| C. | 电子由碳棒经外电路流向锌 | D. | 锌锰干电池属一次电池 |
分析 该原电池中,Zn易失电子作负极,碳棒作正极,负极反应式为Zn-2e-═Zn2+,放电时电子从负极沿导线流向正极,不能多次充放电的电池为一次电池.
解答 解:A.该原电池中,Zn易失电子作负极,碳棒作正极,负极反应式为Zn-2e-═Zn2+,故A正确;
B.根据A知,Zn是负极、碳棒是正极,故B正确;
C.电子从负极沿导线流向正极,则电子从锌沿导线流向正极碳棒,故C错误;
D.锌锰干电池不能多次充放电,所以为一次电池,故D正确;
故选C.
点评 本题考查常见化学电源,明确原电池原理是解本题关键,知道正负极的判断方法、电极反应式的书写及离子流向即可解答,易错点是电极反应式的书写.

练习册系列答案
相关题目
19.通过复习总结,下列归纳正确的是( )
| A. | 有单质参加的反应,置换反应一定都属于氧化还原反应 | |
| B. | 简单非金属阴离子只有还原性,而金属阳离子只有氧化性 | |
| C. | 离子化合物在熔融态都能够导电,共价化合物在熔融态都不导电 | |
| D. | 所有物质都有化学键 |
4.图表法、图象法是常用的科学研究方法.请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
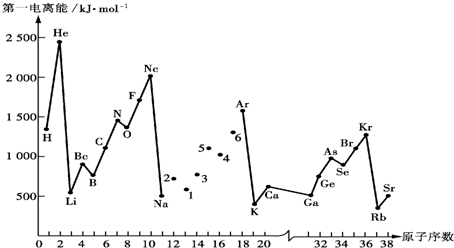
①将Na-Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图象.从上图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小
②上图折线中数字5代表元素在周期表中的位置是第三周期ⅤA族;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键(填离子键或共价键).
②某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(3)已知:波长为300nm的紫外光的光子所具有的能量约为399kJ/mol.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.

①将Na-Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图象.从上图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小
②上图折线中数字5代表元素在周期表中的位置是第三周期ⅤA族;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
②某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(3)已知:波长为300nm的紫外光的光子所具有的能量约为399kJ/mol.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
| C--C | C--N | C--S | |
| 键能 KJ/mol | 347 | 305 | 259 |
14.下列说法正确的是( )
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | 共价键有方向性,但无饱和性 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子化合物 |
18.如图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
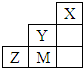
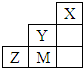
| A. | 非金属性:Y>M>Z | |
| B. | Y、Z、M的氢化物分子各原子最外层均满足8e-稳定结构 | |
| C. | 原子半径:M>Z>Y | |
| D. | Y 的最高价氧化物的水化物的化学式为HYO4 |

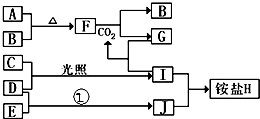 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种固氮反应. .
. 2NH3的化学方程式.
2NH3的化学方程式.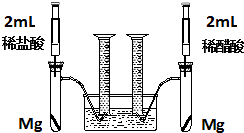 实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图: