题目内容
13.下列各组物质中,化学键的类型相同的是( )| A. | CaCl2和Na2S | B. | Na2O和Na2O2 | C. | N2和Ne | D. | HCl和NaOH |
分析 化学键分为离子键和共价键,离子键为阴阳离子之间的静电作用,共价键为相邻原子之间的较强作用力,从组成上判断,活泼金属与活泼非金属性形成离子键,非金属性原子之间形成共价键,以此解答该题.
解答 解:A.CaCl2、Na2S为离子化合物,含有离子键,化学键的类型相同,故A正确;
B.Na2O只含有离子键,Na2O2含有离子键和共价键,化学键类型不同,故B错误;
C.N2含有共价键,Ne为单原子分子,不存在化学键,故C错误;
D.HCl含有共价键,NaOH2含有离子键和共价键,化学键类型不同,故D错误.
故选A.
点评 本题考查化学键的类型,为高频考点,学生应注意离子化合物中可能存在共价键,共价化合物中一定不存在离子键来解答.

练习册系列答案
相关题目
4.铅蓄电池工作时反应的化学方程式为Pb+PbO2+2H2SO4═2PbSO4+H2O.下列关于该电池的说法正确的是( )
| A. | 铅蓄电池电池是一次电池 | |
| B. | 负极反应式为Pb-2e-═Pb2+ | |
| C. | 连续工作后电解液的酸性将减小 | |
| D. | 工作中,每转移0.2 mol电子时,负极质量减少6.5 g |
1.某化合物的结构式 (键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
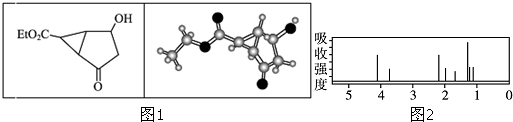

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
8.下列实验能达到目的是( )
| A. | 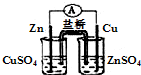 构成锌-铜原电池 | B. |  碘的CCl4溶液中分离I2并回收CCl4 | ||
| C. |  制取O2 | D. | 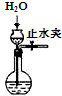 检查装置气密性 |
18.下列反应的离子方程式正确的是( )
| A. | 钠与水的反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe++Cu=Fe2++Cu2+ | |
| D. | 氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O |
5.下列关于有机物的说法中,正确的是( )
| A. | 乙烯、乙炔均能使溴水和酸性高锰酸钾溶液褪色,但褪色的原理不一样 | |
| B. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| C. | “乙醇汽油”是在汽油里加入适量乙醇而形成的一种燃料,它是一种新型化合物 | |
| D. | 乙炔在实验室制取时,用长颈漏斗将饱和食盐水加入圆底烧瓶中与电石反应 |
2.下列关于元素周期表和元素周期律的说法错误的是( )
| A. | 因为K比Na容易失去电子,所以K比Na的还原性强 | |
| B. | 第二周期元素从Li到F,非金属性逐渐增强 | |
| C. | 在金属和非金属的分界线处,可以找到用于作催化剂的元素 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
20.下列说法正确的是( )
| A. | O2、O3互为同位素 | |
| B. | 1H、2 H、3 H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 乙烷、乙烯互为同分异构体 |
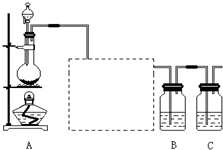 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: