题目内容
【题目】合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g)![]() 2NH3(g) H
2NH3(g) H
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
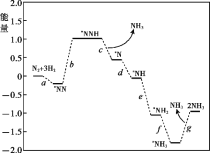
① NH3的电子式是_______。
② 写出步骤c的化学方程式_______。
③ 由图像可知合成氨反应的H______0(填“>”、“<”或“=”)。
(2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0 L的反应容器中投入5 mol N2、15 mol H2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:

① 温度T1、T2、T3大小关系是_______。
② M点的平衡常数 K = _______(可用分数表示)。
(3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如下:
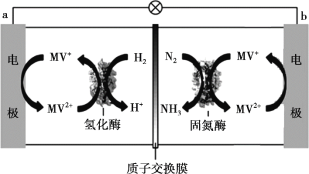
① 导线中电子移动方向是_______。
② 固氮酶区域发生反应的离子方程式是_______。
③ 相比传统工业合成氨,该方法的优点有_______。
【答案】![]() *NNH + H2
*NNH + H2![]() *N + NH3 < T1< T2 < T3 7.32×10-3 a → b N2 + 6H+ + 6 MV+ = 2NH3 + 6 MV2+ 条件温和、生成氨的同时释放电能
*N + NH3 < T1< T2 < T3 7.32×10-3 a → b N2 + 6H+ + 6 MV+ = 2NH3 + 6 MV2+ 条件温和、生成氨的同时释放电能
【解析】
(1)①根据氨气的中心原子N,最外层有5个电子,与三个氢原子形成三对共用电子对,还剩一对孤对电子,得到电子式;
②根据图像,写出化学方程式;
③能量值是降低的,故反应放热,可以判断H的大小;
(2)合成氨的反应放热,升高温度,平衡向吸热的方向移动,根据图像,在相同的压强下,温度越高,氨气的质量分数越小,可以得到T1、T2、T3大小关系;根据M点氨气的质量分数,利用三段式求出M点的化学平衡常数;
(3)生物燃料电池的工作原理是N2+3H2![]() 2NH3,其中N2在正极区得电子发生还原反应,H2在负极区失电子发生氧化反应,原电池工作时阳离子向正极区移动,据此分析判断。
2NH3,其中N2在正极区得电子发生还原反应,H2在负极区失电子发生氧化反应,原电池工作时阳离子向正极区移动,据此分析判断。
(1)①根据氨气的中心原子N,最外层有5个电子,与三个氢原子形成三对共用电子对,还剩一对孤对电子,得到电子式![]() ,
,
故答案为:![]() ;
;
②根据图像,化学方程式:*NNH + H2![]() *N + NH3,
*N + NH3,
故答案为:*NNH + H2![]() *N + NH3;
*N + NH3;
③能量值是降低的,故反应放热,可以判断H<0,
故答案为:<;
(2) ①合成氨的反应放热,升高温度,平衡向吸热的方向移动,根据图像,在相同的压强下,温度越高,氨气的质量分数越小,故温度T1< T2 < T3,
故答案为:T1< T2 < T3;
②设变化的氮气的物质的量浓度为x
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
开始 5 15 0
变化 x 3x 2x
平衡 5-x 15-3x 2x
M点氨气的质量分数为40%,
则![]() ×100%=40%,解得x =2,
×100%=40%,解得x =2,
故K=![]() =
=![]() =7.32×10-3,
=7.32×10-3,
故答案为:7.32×10-3;
(3) ①根据图示,a极区,氢气被氧化为氢离子,故MV+→MV2+被氧化,因此a为负极,b为正极,导线中电子移动方向是a → b,
故答案为:a → b;
② 根据图示,固氮酶区域发生反应为氮气和MV+反应生成氨气和MV2+,根据氧化还原反应规律,该离子方程式N2+6H++6MV+=2NH3+6MV2+,
故答案为:N2+6H++6MV+=2NH3+6MV2+;
③传统工业合成氨反应条件为高温、高压、催化剂,反应条件苛刻,该方法制取氨气条件温和、生成氨的同时释放电能,
故答案为:条件温和、生成氨的同时释放电能。