题目内容
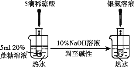
【题目】某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
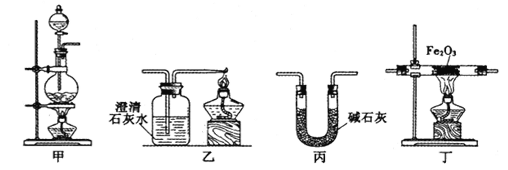
(1)装置甲中发生的反应为:HCOOH(甲酸)![]() CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→(_____)→(_____)→(_____)
(3)丙装置中碱石灰的作用是__________________________。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为__________。
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
加热方式 | 通CO加热时间/min | 澄清石灰水变浑浊时间/min | 产物颜色 | 产物能否全部被磁铁吸引 |
酒精灯 | 30 | 5 | 黑色 | 能 |
酒精喷灯 | 30 | 1 | 黑色 | 能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:____、____。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.________;iii.___________。
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
样品序号 | 加热方式 | 元素组成和质量分数 |
产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
产物样品II | 酒精喷灯 | w(Fe)=100% |
样品I的成分及质量分数为______________________。
【答案】a 丙 丁 乙 除去一氧化碳中的甲酸和水蒸气 丁甲乙 碳单质不会被磁铁吸引 从氧化还原角度分析不可能生成碳单质等 全部为四氧化三铁 四氧化三铁和铁的混合物 w(Fe3O4)=92.8%、w(Fe)=7.20%
【解析】
(1)由于甲酸是一种无色有刺激性气味的液体。为了防止产生大量的甲酸蒸气扩散到空气中,加热浓硫酸与甲酸的混合物制取CO的操作方法是甲酸滴入浓硫酸,选项是a;
(2)用甲装置制取CO,用碱石灰干燥CO并除去挥发的甲酸蒸气,然后将干燥的CO通入Fe2O3的装置,发生反应:3CO+ Fe2O3 ![]() 2Fe+3CO2.,反应产物可以用乙装置的澄清石灰水检验,CO是大气污染物,用点燃的方法除去。因此合适的顺序连接好以下装置:甲—丙—丁—乙;
2Fe+3CO2.,反应产物可以用乙装置的澄清石灰水检验,CO是大气污染物,用点燃的方法除去。因此合适的顺序连接好以下装置:甲—丙—丁—乙;
(3)丙装置中碱石灰的作用是除去一氧化碳中的甲酸和水蒸气;
(4)实验将近完成时,先熄灭装置丁中的酒精灯,使产生的Fe在CO环境中冷却,然后熄灭制取CO的甲装置的酒精灯,最后熄灭尾气处理的乙装置中酒精灯;
(5) ①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:碳单质不会被磁铁吸引,Fe会磁铁吸引,而且从氧化还原角度分析不可能生成碳单质等;②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.全部为四氧化三铁;iii.四氧化三铁和铁的混合物;③完全是Fe3O4,则w(Fe)= (56×3)÷(56×3+16×4)=72.4%、w(O)=27.6%, 假如样品I中Fe的含量是74.4%>72.4%,说明为Fe和Fe3O4的混合物。设总质量为m,其中Fe的含量是x,Fe3O4的含量是(1-x),则[xm+(56×3)÷(56×3+16×4)×(1-x)] ÷m=74.4%,解得x=7.20%,(1-x)=92.8%。即w(Fe)=7.20%、w(Fe3O4)=92.8%。

【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有三个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是 |
![]() 用化学用语回答下列问题:
用化学用语回答下列问题:
![]() 元素在周期表中的位置 ______ ;
元素在周期表中的位置 ______ ;![]() 单质分子的电子式 ______ ;
单质分子的电子式 ______ ;
![]() 的原子结构示意图 ______ ;
的原子结构示意图 ______ ;![]() 电子式表示A和B元素组成的化合物的形成过程: ______ .
电子式表示A和B元素组成的化合物的形成过程: ______ .
![]() 元素D与元素A相比,非金属性较强的是 ______
元素D与元素A相比,非金属性较强的是 ______ ![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是 ______
,下列表述中能证明这一事实的是 ______ ![]() 填选项序号
填选项序号![]() .
.
![]() 常温下D的单质和A的单质状态不同
常温下D的单质和A的单质状态不同
![]() 的氢化物比A的氢化物稳定
的氢化物比A的氢化物稳定
![]() 一定条件下D和A的单质都能与钠反应
一定条件下D和A的单质都能与钠反应
![]() 最高价含氧酸的酸性弱于D最高价含氧酸
最高价含氧酸的酸性弱于D最高价含氧酸
![]() 单质能与A的氢化物反应生成A单质
单质能与A的氢化物反应生成A单质
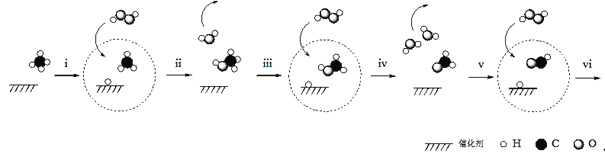
![]() 是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为
是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为![]() 其他条件略去
其他条件略去![]() .
.
![]()
![]() 若Y是有刺激性气味的无色气体,把Y通入
若Y是有刺激性气味的无色气体,把Y通入![]() 溶液中,无现象,然后滴加适量
溶液中,无现象,然后滴加适量![]() 溶液,有白色沉淀生成,则该白色沉淀为 ______ ,试写出Y与
溶液,有白色沉淀生成,则该白色沉淀为 ______ ,试写出Y与![]() 溶液反应的化学方程式: ______ ;
溶液反应的化学方程式: ______ ;
![]() 若Z是红棕色气体,则
若Z是红棕色气体,则![]() 的反应中氧化剂与还原剂物质的量之比为 ______ .
的反应中氧化剂与还原剂物质的量之比为 ______ .
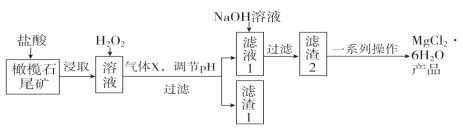
【题目】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:
已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有____________、__________(任写两种)。
(2)气体X的电子式为________,滤渣1经过处理可以制得一种高效的无机高分子混凝剂、净水剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为________。
(3)加入H2O2的目的是______________________;若将上述过程中的“H2O2”用“NaClO”代替也能达到同样目的,则发生反应的离子方程式为:________________________________。
(4)“一系列操作”主要包括加入足量盐酸,然后经过____________________、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000 g氯化镁晶体产品于250 mL锥形瓶中,加水50 mL使其完全溶解,加入100 mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.5000 mol/L的EDTA标准溶液进行滴定,其反应原理为Mg2++Y4- ==MgY2-,滴定终点时消耗EDTA标准溶液的体积19.00 mL。
①则产品中MgCl2·6H2O的质量分数为________(结果保留三位有效数字)。
②下列滴定操作会导致测量结果偏高的是________(填字母)。
a.滴定终点时仰视读数 b.锥形瓶洗涤后没有干燥
c.滴定时锥形瓶中有液体溅出 d.滴定管滴定前有气泡,滴定后气泡消失