题目内容
13.4p轨道填充一半电子的元素,其原子序数是( )| A. | 15 | B. | 33 | C. | 35 | D. | 20 |
分析 根据核外电子排布规律可知,4p轨道填充一半的元素,原子核外电子排布式为1s22s22p63s23p63d104s24p3,原子序数=核外电子数以此解答该题.
解答 解:4p轨道填充一半的元素,根据核外电子排布规律可知,原子核外电子排布式为1s22s22p63s23p63d104s24p3,原子核外有33个电子,则原子序数为33,故选B.
点评 本题考查原子核外电子排布,题目难度不大,本题注意根据4p轨道填充一半判断应为3个电子,根据能量最低原理可写出电子排布式.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
3.已知在苯分子中,不存在单、双键交替的结构.下列可以作为证据的实验事实是:
①苯不能使酸性KMnO4溶液褪色 ②苯中6个碳碳键完全相同
③苯能在一定条件下与氢气加成生成环己烷 ④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色( )
①苯不能使酸性KMnO4溶液褪色 ②苯中6个碳碳键完全相同
③苯能在一定条件下与氢气加成生成环己烷 ④实验室测得邻二甲苯只有一种结构
⑤苯不能使溴水因反应而褪色( )
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
8.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | Na2O2和H2O2 | C. | NaCl和HCl | D. | CCl4和CS2 |
18.与NO3-互为等电子体的是( )
| A. | SO3 | B. | BF3 | C. | CH4 | D. | NO2 |
5.下表是元素周期表的一部分( 注意:用元素符号或化学式填空)
(1)C的离子的结构示意图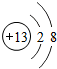 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
(2)H元素的单质的电子式 ;
;
(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程
(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
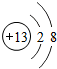 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3(2)H元素的单质的电子式
 ;
;(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程

(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
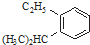 的炔烃的结构简式
的炔烃的结构简式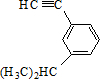 ;
; ;
;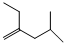 .
.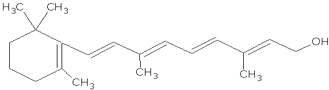 1mol维生素A最多能与5mol溴发生加成反应.
1mol维生素A最多能与5mol溴发生加成反应.