题目内容
1.在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).
回答下列问题:
(1)写出H的电子式:

(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
Ⅰ.实验需要检验出C、D、E三种气体产物,三神气体检验的先后顺序是H2O、SO2、CO2(用化学式填空),在检验D气体前,需除去C气体,所用试剂是酸性高锰酸钾溶液(请从品红溶液、饱和石灰水、高锰酸钾溶液中选),反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
Ⅱ.已知:
A(s)+O2(g)=AO2(g)△H=-393.5kJ•mol-1
2A(s)+O2(g)=2AO(g)△H=-221.0kJ•mol-1
则表示AO的燃烧热的热化学方程式CO(s)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1.
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①离子方程式
2OH-+NH4++HSO3- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-.
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是AlO2-+4H+=Al3++2H2O..
分析 E为常温下无色无味的液体,则E为H2O,F为淡黄色粉末,G为常见的无色气体,由反应②可知,F为Na2O2.则G为O2,H为NaOH;
若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则A为C,B为浓硫酸;
若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,则A为氢氧化钡,B为亚硫酸氢铵;
若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,则A为盐酸或硫酸等,B为NaAlO2,以此来解答.
解答 解:E为常温下无色无味的液体,则E为H2O,F为淡黄色粉末,G为常见的无色气体,由反应②可知,F为Na2O2.则G为O2,H为NaOH;
(1)H为NaOH,其电子式为 ,
,
故答案为: ;
;
(2)反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,C、D是二氧化碳和二氧化硫,E为水,C、D、E是浓硫酸和碳反应的产物,C、D、E三种气体产物分别为CO2、SO2、H2O,则反应①的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
①三种气体检验的先后顺序,水蒸气用无水硫酸铜检验,需要放在第一步,二氧化碳和二氧化硫都能和氢氧化钙反应生成沉淀,所以需要第二步检验二氧化硫,除去二氧化硫后再检验二氧化碳气体;因为石灰水与二氧化碳、二氧化硫都能反应,而品红溶液不能完全除去二氧化硫,所以除去二氧化硫最好选用酸性高锰酸钾溶液;发生的反应为酸性溶液中二氧化硫被氧化为硫酸,高锰酸根离子被还原为锰离子,反应的离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,
故答案为:H2O、SO2、CO2;酸性高锰酸钾溶液;2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
②由a.C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1、b.2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1可知,结合盖斯定律(a×2-b)×$\frac{1}{2}$得到CO的燃烧热的热化学方程式为CO(s)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
故答案为:CO(s)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1;
(3)B是一种酸式盐,且B遇盐酸产生能使品红溶液褪色的气体,气体为二氧化硫,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,强碱与酸式盐反应生成气体,该气体是氨气,则A、B的反应是强碱和亚硫酸氢铵的反应,当A过量时,反应①的离子方程式是2OH-+NH4++HSO3- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-,
故答案为:2OH-+NH4++HSO3- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-;
(4)B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,所以B是偏铝酸钠,A是一种强酸,酸先和偏氯酸钠反应生成氢氧化铝,氢氧化铝和过量的酸反应生成铝离子,则A过量时反应①的离子方程式是AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握物质的性质、发生的反应及转化关系为解答的关键,侧重分析、推断能力的考查,题目难度中等.

| A. | CH4 C2H4 | B. | CH4 C3H6 | C. | C2H6 C3H4 | D. | C2H2 C3H6 |
| A. | 该金刚石粉末与水混和后能产生丁达尔现象 | |
| B. | 该反应属于置换反应 | |
| C. | CCl4和CH4在常温下均为无色气体 | |
| D. | 金刚石属于非金属单质 |
①四氯化碳②苯③溴苯④植物油⑤乙醇⑥乙酸乙酯⑦乙酸.
| A. | ②④⑥ | B. | ①②③④⑤ | C. | ④⑥ | D. | ①②③ |
| A. | 纤维素、蛋白质都是有机高分子化合物 | |
| B. | 苯、甲苯等是煤的主要成分 | |
| C. | 花生油、牛油都是酯类 | |
| D. | 豆浆、牛奶可作为误食重金属盐的解毒剂 |
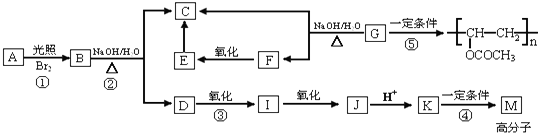
 +Br2$\stackrel{光照}{→}$
+Br2$\stackrel{光照}{→}$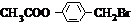 +HBr,反应③:
+HBr,反应③: .
.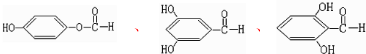 任意一种即可.
任意一种即可. .
. .
.