题目内容
6.某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图1所示,由图中数据分析:
(1)该反应的化学方程式为Y+2Z?3X
(2)反应开始至3分钟末,X的反应速率为:0.1mol/(L•min)
(3)该反应是由正逆同时开始开始反应的.(正、逆或正逆同时)
(4)可逆反应:aA(g)+bB(g)?cC(g)+dD(g);根据图2、图3回答:
①压强 P1比P2小(填大或小);
②(a+b)小于(填大于或小于)(c+d);
③温度t1℃比t2℃高(填高或低);
④正反应为吸热反应(填吸热或放热).
分析 (1)根据反应中浓度的变化写出化学方程式;
(2)根据3min内X浓度的变化计算得出;
(3)根据平衡开始时,各物质的物质的量判断;
(4)根据先拐先平衡判断:t1>t2,p2>p1.温度升高,A的百分含量减小,说明平衡正向移动,△H>0,增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动,以此解答该题.
解答 .解:(1)根据图象可知Y、Z浓度降低,为反应物,X浓度增大为生成物,当物质的量不再变化时,达到平衡状态,此时△n(Y)=1.2mol-1.0mol=0.2mol,△n(Z)=2.0mol-1.6mol=0.4mol,△n(X)=1.0mol-0.4mol=0.6mol,计量数之比等于△n(Y):△n(Z):△n(X)=1:2:3,化学方程式可写为Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至3min末,△n(X)=1.0mol-0.4mol=0.6mol,△c(X)=$\frac{0.6mol}{2L}$=0.3mol/L,化学反应速率为$\frac{0.3mol/L}{3min}$=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(3)反应刚开始时,反应物和生成物物质的量均不为零,即化学平衡是由正、逆反应同时开始反应的,
故答案为:正逆同时开始;
(4)①由图象可知时P2先达到平衡,说明P2压强较大,反应速率较大,则压强 P1比P2小,故答案为:小;
②增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动,则(a+b)比(c+d)小,说故答案为:小于;
③由图象可知t1℃时先达到平衡,温度较高,则温度t1℃比t2℃高,故答案为:高;
④温度升高,A的百分含量减小,说明平衡正向移动,△H>0,故答案为:吸热.
点评 本题考查化学平衡的变化图象,题目难度不大,本题注意化学方程式的确定方法,以及反应速率计算,特别是注意外界条件对平衡移动的影响与反应方程式的关系.

| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
(1)CO2+2OH-═CO32-+H2OCO2+2NaOH=Na2CO3+H2O
(2)Zn+2H+═Zn2++H2↑Zn+H2SO4═ZnSO4+H2↑.
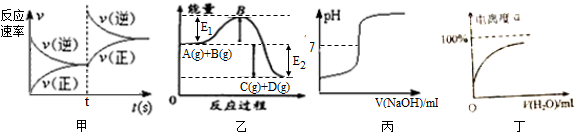
| A. | 图甲中的反应可表示为A(g)+B(g)=C(g)+D(g);△H=-(E1+E2)KJ/mol | |
| B. | 图乙可表示改变某化学平衡体系的温度时,反应速率随时间的变化情况 | |
| C. | 图丙表示向稀盐酸中滴加氢氧化钠溶液时,溶液pH的变化情况 | |
| D. | 图丁表示某弱电解质随着稀释其电离度的变化情况 |
①SO2②CH3CH2CH═CH2③
 ④
④
| A. | ①②③④ | B. | ③④ | C. | ①② | D. | ①②④ |
| A. | 酸性强弱:H3PO4>H2SO4>HClO4 | B. | 原子半径大小:S>Na>O | ||
| C. | 碱性强弱:LiOH>NaOH>KOH | D. | 还原性强弱:I->Br->Cl- |

 ,反应类型为加聚反应.
,反应类型为加聚反应.

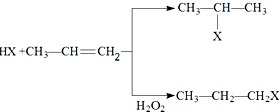 (X为卤素原子)
(X为卤素原子)
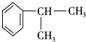 ,E的结构简式
,E的结构简式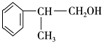 ;
;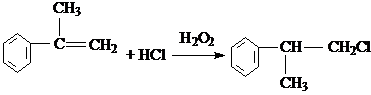 ;
;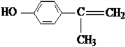 、
、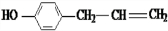 、
、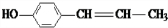 .
.