题目内容
13.2007年10月24日我国自主研发的第一颗月球探测卫星“嫦娥一号”的成功发射,“嫦娥一号”三级火箭所用的燃料是高性能、高纯度的液氢燃料和液氧氧化剂,氢气不仅是一种高能燃料,也是一种可再生的绿色能源.(1)氢气的燃烧热为285.8kJ/mol,写出其燃烧的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8kJ/mol.
(2)实验测得1mol H2与1mol Cl2完全反应放出184.6kJ的热量,又知1mol H2分子中化学键断裂时需要吸收436kJ的能量,1mol Cl2分子中化学键断裂需要吸收243kJ的能量.则1mol HCl分子中化学键断裂时需要吸收431.8kJ的能量.
(3)已知2H2O(g)═2H2(g)+O2(g);△H=+483.6kJ/mol
N2(g)+2O2(g)═2NO2(g);△H=+67.8kJ/mol
3H2(g)+N2(g)═2NH3(g);△H=-92.0kJ/mol
则1mol NH3(g) 燃烧生成NO2(g)和H2O(g)的反应热△H=-282.8kJ/mol.
分析 (1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析书写,其中水是液态水,反应热的单位和符号不能漏写;
(2)依据反应焓变=反应物键能总和-生成物键能总和计算;
(3)依据热化学方程式,①2H2O(g)═2H2(g)+O2(g)△H=+483.6kJ/mol
②N2(g)+2O2(g)═2NO2 △H=+67.8kJ/mol
③3H2(g)+N2(g)═2NH3(g)△H=-92.0kJ/mol
根据盖斯定律计算所需热化学方程式为[(②-③)×2-①×3]×$\frac{1}{4}$得到NH3(g)+$\frac{7}{4}$O2(g)═NO2 +$\frac{3}{2}$H2O(g)△H=-282.8kJ/mol.
解答 解:(1)氢气的燃烧热为285.8kJ/mol,是指1mol氢气完全燃烧生成液态水放出的热量,其燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8kJ/mol;
(2)实验测得1mol H2与1mol Cl2完全反应放出184.6kJ的热量,又知1mol H2分子中化学键断裂时需要吸收436kJ的能量,1mol Cl2分子中化学键断裂需要吸收243kJ的能量,1mol HCl分子中化学键断裂时需要吸收能量x,反应焓变=反应物键能总和-生成物键能总和,-184.6KJ/mol=436KJ/mol+243KJ/mol-2x,x=431.8KJ/mol
则1mol HCl分子中化学键断裂时需要吸收431.8kJ;
故答案为:431.8kJ;
(3)①2H2O(g)═2H2(g)+O2(g);△H=+483.6kJ/mol
②N2(g)+2O2(g)═2NO2;△H=+67.8kJ/mol
③3H2(g)+N2(g)═2NH3(g);△H=-92.0kJ/mol
[(②-③)×2-①×3]×$\frac{1}{4}$得到NH3(g)+$\frac{7}{4}$O2(g)═NO2 +$\frac{3}{2}$H2O(g)△H=-282.8kJ/mol;
则1mol NH3(g)燃烧生成NO2(g)和H2O(g)的反应热△H=-282.8kJ/mol;
故答案为:-282.8kJ/mol.
点评 本题考查了热化学方程式书写方法和盖斯定律计算应用,注意利用键能计算焓变的方法,掌握基础是关键,题目难度中等.

| A. | 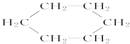 属于环状化合物 属于环状化合物 | B. |  属于卤代烃 属于卤代烃 | ||
| C. |  属于链状化合物 属于链状化合物 | D. | 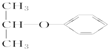 属于醚 属于醚 |
| A. | 碳酸钙跟稀盐酸反应CO32-+2H+=CO2↑+H2O | |
| B. | 向碳酸钠溶液中加入过量醋酸溶液CO32-+2H+=CO2↑+H2O | |
| C. | 氯气与水反应Cl2+H2O=2H++Cl-+ClO- | |
| D. | 三氯化铝溶液与氨水Al3++3NH3•H2O=Al(OH)3↓+3NH4 + |
| A. | 已知H2C2O4为二元弱酸,则Na2C2O4溶液:c(OH- )=c(H+ )+c(H2C2O4-)+c(H2C2O4) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:2c(S2-)+c(OH-)+c(HS-)=c(H+)+c(Na+) |


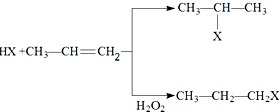 (X为卤素原子)
(X为卤素原子)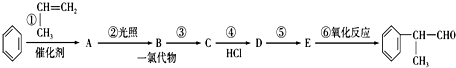
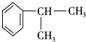 ,E的结构简式
,E的结构简式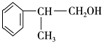 ;
;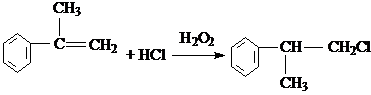 ;
;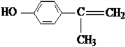 、
、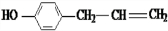 、
、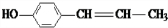 .
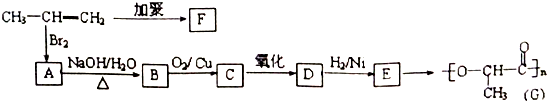
.
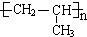 .
.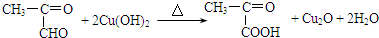 .
.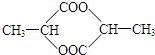 .
.