题目内容
9.A、B、C、D、E五种元素,它们的核电荷数依次增大,且均小于20.其中C、E是金属元素,A、E的最外层上都只有一个电子,B、D元素原子最外层电子数相同,且B元素L层电子数是K层的3倍,C元素最外层电子数是D最外层电子数的一半.回答下列问题:(1)写出它们的元素符号:AH;CAl;DS.
(2)写出B原子的电子式:
 .
.(3)画出C元素离子的结构示意图:
 .
.(4)写出与E元素离子具有相同核外电子排布的两个微粒的符号:S2-和Ca2+.
分析 A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,且都小于20,B和D原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,则B为氧元素、D为硫元素;C、E是金属元素,D为硫元素,C元素原子的最外层电子数是D元素原子最外层电子数的一半(6×$\frac{1}{2}$=3),则C为铝元素元素;A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E原子序数大于铝元素,E为K元素,A为氢元素,据此解答.
解答 解:(1)A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,且都小于20,B和D原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,则B为氧元素、D为硫元素;C、E是金属元素,D为硫元素,C元素原子的最外层电子数是D元素原子最外层电子数的一半(6×$\frac{1}{2}$=3),则C为铝元素元素;A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E原子序数大于铝元素,E为K元素,A为氢元素,
故答案为:H;Al;S;
(2)B为氧原子最外层为6个电子,氧原子的电子式为: ,故答案为:
,故答案为: ;
;
(3)C元素是铝离子结构示意图为: ,故答案为:
,故答案为: ;
;
(4)E元素离子是钾离子,具有相同核外电子排布有S2-、Cl-、Ar、Ca2+,故答案为:S2-;Ca2+.
点评 本题考查结构性质位置关系,元素的推断是解答的关键,题目难度不大,注意信息的综合应用来推断,较好的训练学生分析解决问题的能力,旨在考查学生对基础知识的掌握.

练习册系列答案
相关题目
14.下列各选项中,能够说明烯烃分子具有不饱和结构的是( )
| A. | 燃烧 | B. | 取代反应 | C. | 加成反应 | D. | 氧化反应 |
20.以下实验中能够获得成功的是( )
| A. | 将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl) | |
| B. | 将乙醇迅速加热至170摄氏度制乙烯 | |
| C. | 将还原铁粉、液溴和苯混合制溴苯 | |
| D. | 检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验 |
17.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
14.写出能实现下列反应的化学方程式各一个:
(1)CO2+2OH-═CO32-+H2OCO2+2NaOH=Na2CO3+H2O
(2)Zn+2H+═Zn2++H2↑Zn+H2SO4═ZnSO4+H2↑.
(1)CO2+2OH-═CO32-+H2OCO2+2NaOH=Na2CO3+H2O
(2)Zn+2H+═Zn2++H2↑Zn+H2SO4═ZnSO4+H2↑.
19.还原性逐渐增强的是( )
| A. | Na、Mg、Al | B. | Li、Na、K | C. | P、S、Cl | D. | I、Br、Cl |


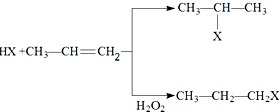 (X为卤素原子)
(X为卤素原子)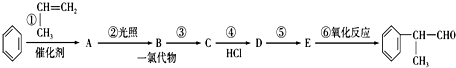
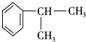 ,E的结构简式
,E的结构简式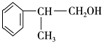 ;
;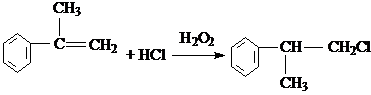 ;
;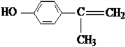 、
、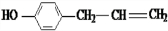 、
、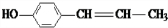 .
.