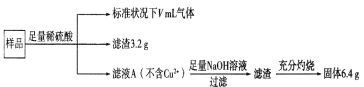题目内容
【题目】(1)已知:2Al(s)+O2(g)=Al2O3(s) △H=-1644.3kJ·mol-1
2Fe(s)+O2(g)=Fe2O3(s) △H=-815.88kJ·mol-1
写出铝粉与氧化铁粉末发生铝热反应的热化学方程式 。
(2)高铁酸钾(K2FeO4)在水中的反应为4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
①pH=4.74时,反应从开始到800min时平均反应速率v(OH-)= 。
②图1在800min后,三种溶液中的c(FeO42-)均不再改变。随着pH的变大,此反应的平衡常数K (填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中FeO42-的浓度不再变化,下列说法正确的是
a.上述反应的△H>0 b.升高温度,该反应pH减小
c.温度越高,反应速率越慢 d.加入盐酸,FeO42-的浓度减小
④FeO42-在水溶液中的存在形态如图3所示。下列说法正确的是
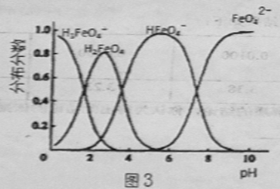
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐变大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
已知:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是 。
(3)常温常压下,饱和氯水中氯气总浓度约为0.09mol/L,且存在可逆反应:Cl2 + H2O ![]() HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O
HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O![]() HCl+HClO的平衡常数为 。
HCl+HClO的平衡常数为 。
【答案】(1)2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) △H=-828.42kJ·mol-1;
(2)①0.001375mmol·L-1·min-1;②不变;③ad;④C;⑤消毒,净化;
(3)4.5×10-4;
【解析】
试题分析:(1)铝热反应的反应物是铝粉与氧化铁粉末,生成物是铁和氧化铝, 2Al (s)+![]() O2(g)═Al2O3(s)△H=-1 644.3kJmol-1 ①,2Fe (s)+
O2(g)═Al2O3(s)△H=-1 644.3kJmol-1 ①,2Fe (s)+![]() O2(g)═Fe2O3(s)△H=-815.88kJmol-1 ②,方程式①-②得2Al (s)+Fe2O3(s)=Al2O3(s)+2Fe (s)△H=△H(①)-△H(②)=-1 644.3kJmol-1-(-815.88kJmol-1)=-828.42 kJ mol-1,故答案为:2Al (s)+Fe2O3(s)═Al2O3(s)+2Fe (s)△H=-828.42 kJmol-1;
O2(g)═Fe2O3(s)△H=-815.88kJmol-1 ②,方程式①-②得2Al (s)+Fe2O3(s)=Al2O3(s)+2Fe (s)△H=△H(①)-△H(②)=-1 644.3kJmol-1-(-815.88kJmol-1)=-828.42 kJ mol-1,故答案为:2Al (s)+Fe2O3(s)═Al2O3(s)+2Fe (s)△H=-828.42 kJmol-1;
(2)①图象分析可知pH=4.74时,反应从开 始到800min,消耗FeO42-离子浓度为1.0mol/L-0.45mol/L=0.55mol/L,反应的平均反应速率v(FeO42-)=×![]() =6.875×10-7 mol/(Lmin),v(OH-)=2v(FeO42-)=1.376×10-6mol/(Lmin);故答案为:1.376×10-6mol/(Lmin);
=6.875×10-7 mol/(Lmin),v(OH-)=2v(FeO42-)=1.376×10-6mol/(Lmin);故答案为:1.376×10-6mol/(Lmin);
②平衡常数随温度变化,不随溶液酸碱性,离子浓度变化,随着pH 变大,此反应的平衡常数不变,故答案为:不变;
③A.依据图象分析可知随温度升高消耗FeO42-浓度增大,平衡正向进行,温度升高平衡向吸热反应方向进行,故反应 是吸热反应,△H>0,正确;b.根据4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2 △H>0,升高温度,平衡正向移动,pH增大,错误;c.温度越高,反应速率越快,错误;d.加入盐酸,平衡正向移动,FeO42-的浓度减小,正确;故选ad;
4Fe(OH)3+8OH-+3O2 △H>0,升高温度,平衡正向移动,pH增大,错误;c.温度越高,反应速率越快,错误;d.加入盐酸,平衡正向移动,FeO42-的浓度减小,正确;故选ad;
④A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;B、向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数先增大随后又减小,故B错误;C、pH=6的这种溶液中,铁元素的存在形态有HFeO4-和FeO42-,加KOH溶液,只有HFeO4-能反应,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C正确;故答案为C;
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;故答案为:杀菌消毒、吸附悬浮物;
(3)饱和氯水中氯气总浓度约为0.09mol/L,则
Cl2+H2O![]() H+ + Cl- + HClO
H+ + Cl- + HClO
起始浓度:0.09mol/L 0 0 0
转化浓度:0.03mol/L 0.03mol/L 0.03mol/L 0.03mol/L
平衡浓度:0.06mol/L 0.03mol/L
所以K=![]() =
=![]() =4.5×10-4;故答案为:4.5×10-4。
=4.5×10-4;故答案为:4.5×10-4。

【题目】
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 .
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体;
d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 ,上述操作正确的顺序是 (填序号)
(3)已知:I2+2S2O32﹣═2I﹣+S4O62﹣.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10﹣3mol· L﹣1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。