题目内容
【题目】某温度下,将打磨后的镁条放人盛有50 mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中的pH和浊度随时间的变化(如图所示,实线表示溶液pH随时间的变化)。下列有关描述正确的是( )
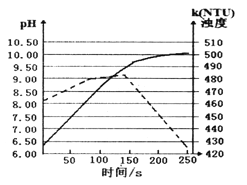
A. 该温度下Mg(OH)2的KSP的数量级约为10-10。
B. 该实验是在常温下进行的
C. 50 s时向溶液中滴人酚酞试液,溶液变红
D. 150 s后溶液浊度下降是因为生成的Mg(OH)2逐渐溶解
【答案】A
【解析】
A.该温度下,当氢氧化镁达到饱和时,pH不变,此时pH=10.00,以此分析;
B. 根据蒸馏水的pH=6.5分析;
C.酚酞的变色范围为8~10,pH小于8时溶液为无色;
D.氢氧化镁为难溶物,氢氧化镁沉降后减小了溶液浊度。
A. 该温度下,当氢氧化镁达到饱和时,pH不变,此时pH=10.00,该温度下Mg(OH)2的KSP=c(Mg2+)c2(OH-)=![]() c(OH-)
c(OH-) ![]() c2(OH-)=
c2(OH-)=![]() c3(OH-),由图可知,该温度下水的离子积Kw=10-6.5
c3(OH-),由图可知,该温度下水的离子积Kw=10-6.5![]() 10-6.5=10-13,所以c(OH-)=
10-6.5=10-13,所以c(OH-)=![]() =10-3mol/L,故KSP=
=10-3mol/L,故KSP=![]() c3(OH-)=
c3(OH-)=![]() =
=![]() 10-9=5
10-9=5![]() 10-10,即该温度下Mg(OH)2的KSP的数量级约为10-10,故A正确;
10-10,即该温度下Mg(OH)2的KSP的数量级约为10-10,故A正确;
B. 常温下蒸馏水的pH=7,而图象中蒸馏水的pH=6.5<7,说明该实验不是在常温下进行的,故B错误;
C. 50 s时溶液的pH小于8,滴入酚酞后溶液为无色,故C错误;
D. Mg(OH)2为难溶物,随着Mg(OH)2的沉降,溶液的浊度会下降,即150 s后溶液浊度下降是因为生成的Mg(OH)2沉降,故D错误。
所以A选项是正确的。

 名校课堂系列答案
名校课堂系列答案【题目】在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2+Br22HBr.已知加入1molH2和2molBr2 时,达到平衡状态生成a molHBr.在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
编号 | 起始状态(mol) | 平衡时HBr 物质的量(mol) | ||
H2 | Br2 | HBr | ||
已知 | 1 | 2 | 0 | a |
① | 2 | 4 | 0 | _____ |
② | _____ | _____ | 1 | 0.5a |
③ | m | n(n≥2m) | _____ | _____ |
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________;
b.该温度下,反应I的平衡常数K=______________。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
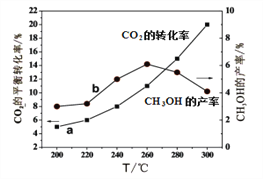
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。