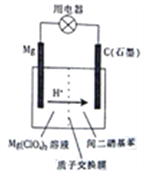
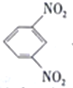
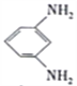
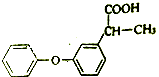
题目内容
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)E元素形成的氧化物对应的水化物的化学式为_______________________________。
(2)元素C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。
(3)用电子式表示化合物D2C的形成过程:_________________。C、D还可形成化合物D2C2,D2C2中含有的化学键类型是_______________________________________________。
(4)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
【答案】 H2SO3、H2SO4 S2->O2->Na+ ![]() 离子键、非极性共价键(或离子键、共价键) NH4NO3 NH4++OH-=NH3H2O 4Na2SO3=Na2S+3Na2SO4
离子键、非极性共价键(或离子键、共价键) NH4NO3 NH4++OH-=NH3H2O 4Na2SO3=Na2S+3Na2SO4
【解析】A元素的原子核内只有1个质子,则A为H元素,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,应为N元素,C元素原子的最外层电子数比次外层多4个,则原子核外电子排布为2、6,应为O元素,C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,应为Na元素,C、E主族,则E为S元素,由以上分析可知A为H元素,B为N元素,C为O元素,D为Na元素,E为S元素。
(1)E为S元素,对应的氧化物的水化物有H2SO3、H2SO4,故答案为:H2SO3、H2SO4;
(2)元素C、D、E形成的离子分别为O2-、Na+、S2-,S2-离子核外有3个电子层,离子半径最大,O2-与Na+离子核外电子排布相同,都有2个电子层,核电核数越大,半径越小,
则半径O2->Na+,故答案为:S2->O2->Na+;
(3)化合物D2C为Na2O,为离子化合物,用电子式表示的形成过程为![]() ,D2C2为Na2O2,为离子化合物,含有离子键和非极性共价键,故答案为:
,D2C2为Na2O2,为离子化合物,含有离子键和非极性共价键,故答案为:![]() ;离子键、非极性共价键(或离子键、共价键);
;离子键、非极性共价键(或离子键、共价键);
(4)由A、B、C三种元素形成的离子化合物为NH4NO3,与强碱溶液反应的实质为NH4++OH-=NH3H2O,故答案为:NH4NO3;NH4++OH-=NH3H2O;
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,应分别为Na2S、Na2SO3、Na2SO4,此反应为分解反应,反应的化学方程式为4Na2SO3=Na2S+3Na2SO4,故答案为:4Na2SO3=Na2S+3Na2SO4。

【题目】我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2等杂质)经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________。
II.以TiO2为原料制备金属钛,流程如下:TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________。
(5)己知碳的燃烧热394kJ/mol,请写出TiO2与Cl2、C反应制取TiCl4的热化学方程式_____________。
III.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:
![]()
(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O的转化率 | 80% | 90% | 97% | 93% | 82% |
该过程的理想温度为_______________,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________,该反应的离子方程式为________________________。