题目内容
【题目】用如图所示装置进行锌与稀硫酸反应速率的测定。下列说法错误的是( )
甲装置: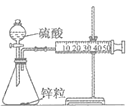 乙装置:
乙装置: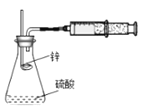
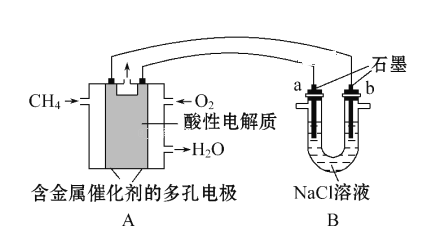
A. 将甲装置分液漏斗旋塞打开,分液漏斗里的液体顺利流下,并不能说明整套装置气密性不好
B. 需要测量单位时间内产生气体的体积或产生一定体积的气体需要的时间
C. 甲装置因为逐滴加入硫酸,硫酸的体积和浓度的变化会造成误差,用乙装置可以减小该误差(乙装置中燃烧匙可上下移动)
D. 只需要将甲装置中锌粒改为铜片,稀硫酸改为浓硫酸,就可以用此装置测定铜与浓硫酸的反应速率
【答案】D
【解析】
A.整体装置是容积可变容器,不是刚性容器,所以分液漏斗旋塞打开,分液漏斗里的液体顺利流下,并不能说明整套装置气密性不好,故A正确;
B.测定反应速率,需要测定时间和产生的气体体积,故B正确;
C.甲装置中稀硫酸溶液进入体系,占用一定体积,活塞右移,且随着稀硫酸溶液不断加入,锥形瓶中反应生成的水越来越多,加入的稀硫酸溶液被稀释,浓度不确定,会造成误差,用乙装置可以减小稀硫酸溶液体积和浓度的变化造成的实验误差,故C正确;
D.铜与浓硫酸的反应需要加热,所以还需要添加加热装置,故D错误。
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |