题目内容
【题目】在粗盐提纯的实验中,每一步中玻璃棒的作用分别是:
溶解(_______) 过滤(_______) 蒸发(_______)
A.引流 B.搅拌,加速固体溶解 C.转移固体 D.搅拌,防止液滴飞溅
【答案】B A D
【解析】
溶解时,玻璃棒的作用是搅拌,加速固体溶解,故选B;
过滤时,玻璃棒的作用是引流,故选A;
蒸发时,玻璃棒的作用是搅拌,防止液滴飞溅,故选D。
答案为:B;A;D。

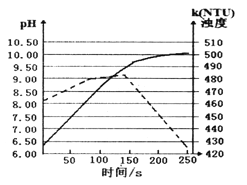
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
【题目】氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
(1)工业上利用N2和H2可以合成NH3,NH3又可以进一步制备肼(N2H4)等.已知:
N2(g)+2O2(g)=2NO2(g)ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534.0kJ·mol-1
2NO2(g)![]() N2O4(g)ΔH=-52.7kJ·mol-1
N2O4(g)ΔH=-52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氨气和气态水的热化学方程式________;
(2)在固定体积密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其平衡常数K与温度T的关系如下表:
2NH3(g)ΔH<0,其平衡常数K与温度T的关系如下表:
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×105 | K1 | K2 |
①该反应的平衡常数表达式:K=________;
②判断K1________K2(填写“>”, “=”或“<”);
③下列各项能说明该反应已达到平衡状态的是________(填字母).
a.v(N2)正=3v(H2)逆
b.混合气体的密度保持不变
c.容器内压强保持不变
d.容器内N2、H2、NH3的浓度之比为1︰3︰2
e.N2和H2的转化率相等
f.体系中气体的平均摩尔质量不再改变
(3)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应.若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的![]() ,则该温度下的化学平衡常数K=________(保留两位小数),以NH3表示该过程的反应速率v(NH3)=________;
,则该温度下的化学平衡常数K=________(保留两位小数),以NH3表示该过程的反应速率v(NH3)=________;
(4)实验室制取氨气的化学反应方程式________。