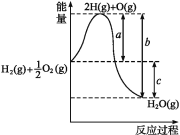
题目内容
【题目】在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2+Br22HBr.已知加入1molH2和2molBr2 时,达到平衡状态生成a molHBr.在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
编号 | 起始状态(mol) | 平衡时HBr 物质的量(mol) | ||
H2 | Br2 | HBr | ||
已知 | 1 | 2 | 0 | a |
① | 2 | 4 | 0 | _____ |
② | _____ | _____ | 1 | 0.5a |
③ | m | n(n≥2m) | _____ | _____ |
【答案】2a00.52(n﹣2m)a(n﹣m)
【解析】
①已知加入1molH2和2molBr2时,达到平衡状态生成a molHBr,根据等效平衡原理:加入2molH2和4molBr2时,反应物的起始量是原来的2倍,则平衡时HBr的量是原平衡的2倍,即HBr的物质的量为2amol,故答案为:2a;
②若平衡时HBr的物质的量为0.5amol,则平衡时HBr的量是原来平衡HBr的物质的量的一半,所以起始时应加入0.5mol H2和1mol Br2,已知起始时有HBr1mol,相当于有0.5mol H2和0.5mol Br2,所以还需0.5molBr2,故起始时只需加入0.5molBr2,故答案为:0;0.5;
③若开始时加入m mol H2和nmol Br2,设起始HBr的物质的量应当为x,则(m+![]() ):(n+
):(n+![]() )=1:2,所以x=2(n-2m),全部折算成反应物后有H2的物质的量为m+
)=1:2,所以x=2(n-2m),全部折算成反应物后有H2的物质的量为m+![]() =n-m,则平衡时HBr的物质的量为:
=n-m,则平衡时HBr的物质的量为:![]() =
=![]() ,所以n(HBr)=a(n-m),故答案为:2(n-2m);a(n-m)。
,所以n(HBr)=a(n-m),故答案为:2(n-2m);a(n-m)。

【题目】温度容积相同的3个密闭容器中,按不同方式投入反应物并保持恒温恒容,测得反应达到平衡时的有关数据如下(已知:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJmol﹣1 )
2NH3(g)△H=﹣92.4kJmol﹣1 )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3molH2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(molL﹣1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | a1 | a2 | a3 |
下列说法正确的是( )
A. 2 c1>c3 B. a1+a3<1 C. 2 p2<p1 D. a=b
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快