题目内容
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。

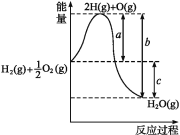
(1) 已知:CH4 、CO, 、H2的燃烧热分别为890. 3 KJ·mol-1、283. 0 KJ·mol-1、285. 8 KJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)![]() 2CO(g)+4H2(g)的△H=_________
2CO(g)+4H2(g)的△H=_________
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:


①用H2表示的前2h的平均反应速率v(H2)=_________
②该温度下,CO2的平衡转化率为______________
(3)在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g)![]() C2H4 (g)+4H2 O(g) △H。在0 .1 MPa时,按
C2H4 (g)+4H2 O(g) △H。在0 .1 MPa时,按![]() (CO2):
(CO2):![]() (H2)=1:3投料,如图所示为不同温度(
(H2)=1:3投料,如图所示为不同温度(![]() )下,平衡时四种气态物质的物质的量(
)下,平衡时四种气态物质的物质的量(![]() )的关系。
)的关系。
①该反应的△H_______0(填“>”或“<”)。
②曲线![]() 表示的物质为______(填化学式)。
表示的物质为______(填化学式)。
【答案】-71.4 kJ·mol-1 0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1 40% ![]() < C2H4
< C2H4
【解析】
(1)根据CH4、、CO和H2的燃烧热分别写出燃烧的热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJmol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1,
③O2(g)+2H2(g)=2H2O(l)△H=-571.6kJmol-1;
根据盖斯定律计算得到所需热化学方程式;
(2) ①恒温恒容时,气体的压强之比等于其物质的量之比,2h时![]() =0.85,求出氢气转化量,进一步求出用氢气表示的反应速率;
=0.85,求出氢气转化量,进一步求出用氢气表示的反应速率;
②该温度下,反应进行5h时达到平衡状态,此时![]() =0.80,求出二氧化碳转化量,进一步求出CO2的平衡转化率;
=0.80,求出二氧化碳转化量,进一步求出CO2的平衡转化率;
(3)根据已知条件,列三行式,求出平衡时各气体成分所占的物质的量的分数,求出分压,进而计算平衡常数;
(4)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,C2H4(g)、H2O(g)都是生成物,随着平衡逆向移动,二者的物质的量逐渐减小,由计量数关系可知曲线b代表水,曲线c代表C2H4。
(1)根据CH4、、CO和H2的燃烧热分别写出燃烧的热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJmol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1,
③O2(g)+2H2(g)=2H2O(l)△H=-571.6kJmol-1;
利用盖斯定律将①![]() 2-②-③×2可得:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71.4kJmol-1,
2-②-③×2可得:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71.4kJmol-1,
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71.4kJmol-1;
(2) ①恒温恒容时,气体的压强之比等于其物质的量之比,2h时![]() =0.85,设消耗CO2的物质的量为xmol,
=0.85,设消耗CO2的物质的量为xmol,
CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g) ![]() V
V
1 3 1 1 2
xmol 2x mol
则有![]() =0.85,解得x=0.3,
=0.85,解得x=0.3,
故前2h的平均反应速率v(H2)=![]() =0.225 mol·L-1·h-1。
=0.225 mol·L-1·h-1。
②该温度下,反应进行5h时达到平衡状态,此时![]() =0.80,设消耗CO2的物质的量为ymol,则有
=0.80,设消耗CO2的物质的量为ymol,则有![]() =0.85,解得y=0.4,
=0.85,解得y=0.4,
故CO2的平衡转化率为![]() ×100%=40%,
×100%=40%,
故答案为:0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1 ;40%;
(3)设开始时投入CO2和H2的物质的量分别为1mol、3mol,CO2的平衡转化率为50%,则有:
CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g)。
CH3OH(g)+ H2O(g)。
起始量/mol 1 3 0 0
转化量/mol 0.5 1.5 0.5 0.5
平衡量/mol 0.5 1.5 0.5 0.5
平衡时p(CO2)=8 MPa×![]() =
=![]() MPa, p(H2)=8 MPa×
MPa, p(H2)=8 MPa×![]() =4 MPa,p(CH3OH)=8 MPa×
=4 MPa,p(CH3OH)=8 MPa×![]() =
=![]() MPa,p(H2O)=8 MPa×
MPa,p(H2O)=8 MPa×![]() =
=![]() MPa,
MPa,
故该反应条件下的平衡常数为Kp=![]() =
=![]() =
=![]() 。
。
故答案为:![]() ;
;
(4)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,ΔH<0。
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,C2H4(g)、H2O(g)都是生成物,随着平衡逆向移动,二者的物质的量逐渐减小,由计量数关系可知曲线b代表水,曲线c代表C2H4。
故答案为:< ;C2H4。

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快