题目内容
8.将0.6mol A和0.5mol B充入0.4L的密闭容器中发生2A(g)+B(g)?D(g)+E(g).5min后达到化学平衡,此时测得D为0.2mol.又知5min内用E表示的反应速率为0.1mol•L-1•min-1,计算:(1)m的值;
(2)平衡时A的物质的总浓度;
(3)平衡时气体的总物质的量.
分析 根据反应速率之比等于化学计量数之比判断m,利用三段式法计算相关物理量,
v(D)=$\frac{\frac{0.2mol}{0.4L}}{5min}$=0.1mol•L-1•min-1,又知5min内用E表示的平均反应速率为0.1mol•L-1•min-1,
则v(D):c(E)=0.1mol•L-1•min-1:0.1mol•L-1•min-1=1:1,
反应速率之比等于化学计量数之比,则m=1,则
2A(g)+B(g)?D(g)+E(g)
起始:0.6mol 0.5mol 0 0
转化:0.4mol 0.4mol 0.2mol 0.2mol
平衡:0.2mol 0.1mol 0.2mol 0.2mol
解答 解:v(D)=$\frac{\frac{0.2mol}{0.4L}}{5min}$=0.1mol•L-1•min-1,又知5min内用E表示的平均反应速率为0.1mol•L-1•min-1,
则v(D):c(E)=0.1mol•L-1•min-1:0.1mol•L-1•min-1=1:1,
反应速率之比等于化学计量数之比,则m=1,则
2A(g)+B(g)?D(g)+E(g)
起始:0.6mol 0.5mol 0 0
转化:0.4mol 0.4mol 0.2mol 0.2mol
平衡:0.2mol 0.1mol 0.2mol 0.2mol
(1)由以上计算可知,D、E的反应速率相同,则m=1,
答:m的值为1;
(2)c(A)=$\frac{0.2mol}{0.4L}$=0.5mol•L-1,
答:平衡时A的物质的总浓度0.5mol•L-1;
(3)平衡时混合物总物质的量为0.2mol+0.1mol+0.2mol+0.2mol=0.7mol,
答:平衡时气体的总物质的量0.7mol.
点评 本题考查了化学平衡的计算应用,主要是反应速率,浓度概念的计算分析,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的即时反应速率最慢的是C.
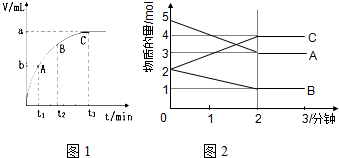
Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).
(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd
a.v(A)=2v(B) b.容器内各物质的物质的量相等
c.v烂(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为40%.

| A. | X、Y、Z元素分别为N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半径:Z>X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
| A. | 石墨转化为金刚石 | B. | NaCl晶体溶于水 | ||
| C. | 干冰升华 | D. | HCl溶于水 |
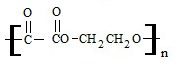 +2nH2O.
+2nH2O.
 .
. .
.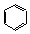 ;CH2=CH2和
;CH2=CH2和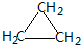 .
.