题目内容
3.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素高正价是+7价 |
①A元素在周期表中的位置第三周期第ⅥA族;
②用电子式表示A和B元素组成的化合物的形成过程
 .
.(2)元素D与元素A相比,D非金属性较强,下列表述中能证明这一事实的是bde.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为1:2.
分析 A元素原子有三个电子层,K、M层电子数之和等于L层电子数,则其M层电子数=8-2=6,故A为硫;B在短周期中金属性最强,则B为Na;常温下C单质为双原子分子,氢化物的水溶液呈碱性,则C为氮元素;D元素最高正价是+7价,且为短周期元素,故D为Cl,
(1)①主族元素周期数=电子层数、族序数=最外层电子数;
②Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成;
(2)元素氢化物稳定性,元素最高价含氧酸的酸性强弱,单质之间的相互置换等可以判断元素非金属性强弱;
(3)A、B、C、D四种元素的最高价氧化物的水化物分别为:硫酸、氢氧化钠、硝酸、高氯酸,氢氧化钠属于碱;
(4)X是由S、Na、N、Cl四种元素中的某种元素组成的单质,
①若Y是有刺激性气味的无色气体,硫元素单质化合物性质符合,可推知X为硫、Y为SO2、Z为SO3、W为H2SO4,SO2被氧化为硫酸,硫酸与氯化钡反应生成硫酸钡与盐酸;
②若Z是红棕色气体,则Z为NO2,则X为N2、Y为NO、W为HNO3,则Z→W的反应为3NO2+H2O=2HNO3+NO,结合氮元素化合价变化判断.
解答 解:A元素原子有三个电子层,K、M层电子数之和等于L层电子数,则其M层电子数=8-2=6,故A为硫;B在短周期中金属性最强,则B为Na;常温下C单质为双原子分子,氢化物的水溶液呈碱性,则C为氮元素;D元素最高正价是+7价,且为短周期元素,故D为Cl,
(1)①A为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期第ⅥA族,
故答案为:第三周期第ⅥA族;
②Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成为: ,
,
故答案为: ;
;
(2)元素氢化物稳定性,元素最高价含氧酸的酸性强弱,单质之间的相互置换等可以判断元素非金属性强弱,物质的状态属于物理性质,不能比较非金属性强弱,与钠的反应不能比较非金属性强弱,
故答案为:bde;
(3)A、B、C、D四种元素的最高价氧化物的水化物分别为:硫酸、氢氧化钠、硝酸、高氯酸,氢氧化钠属于碱,其它三种化合物属于酸,
故答案为:NaOH;
(4)X是由S、Na、N、Cl四种元素中的某种元素组成的单质,
①若Y是有刺激性气味的无色气体,硫元素单质化合物性质符合,可推知X为硫、Y为SO2、Z为SO3、W为H2SO4,SO2通入BaCl2溶液中,然后滴加适量H2O2溶液,SO2被氧化性为硫酸,硫酸与氯化钡反应生成硫酸钡与盐酸,白色沉淀为BaSO4,该反应的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl,
故答案为:BaSO4;BaCl2+SO2+H2O2=BaSO4↓+2HCl;
②若Z是红棕色气体,则Z为NO2,则X为N2、Y为NO、W为HNO3,则Z→W的反应为3NO2+H2O=2HNO3+NO,反应中二氧化氮是氧化剂、还原剂,其氧化剂的二氧化氮生成NO,其还原剂的二氧化氮生成硝酸,故氧化剂与还原剂物质的量之比=1:2,
故答案为:1:2.
点评 本题考查结构性质位置关系应用、无机物推断等,明确元素种类是解答的关键,注意掌握非金属性、金属键强弱比较规律,难度中等.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案 ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| C. | 同素异形体:活性炭,C60,C80,金刚石 | |
| D. | 混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
| A. | 铜和稀硝酸反应 | B. | 氮气和氧气发生反应 | ||
| C. | 二氧化氮气体溶于水 | D. | 氨的催化氧化 |
| A. | 0.27 s | B. | 0.44 s | C. | 1.33 s | D. | 2 s |
| A. | 氢硫酸 | B. | 二氧化碳 | C. | 氯化钾 | D. | 醋酸钠 |
①NaHCO3溶液 ②NaHSO4溶液 ③NaCl溶液 ④AlCl3溶液 ⑤NaClO溶液.
| A. | ①<②<③<④<⑤ | B. | ④<②<①<③<⑤ | C. | ②<④<③<①<⑤ | D. | ②<④<①<③<⑤ |
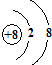 E的氢化物的电子式
E的氢化物的电子式 .
.