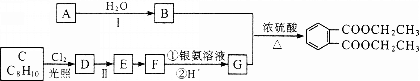
题目内容
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
【答案】(1)防止FeSO4被氧气氧化;除去铁屑表面的油污(2)n(CO2)= n(MnCO3)=0.01 mol
n(EDTA)=0.0014mol
10 mL溶液中 n(Mn2+)=0.0014mol
7.390 g 该碱式碳酸锰中n(Mn2+)=0.07mol,n[Mn(OH)2]=0.06 mol
m(H2O)=0.9 g ,nH2O)=0.05 mol
a∶b∶c= 1∶6∶5
碱式碳酸锰的化学式为MnCO3·6Mn(OH)2·5H2O
【解析】
试题分析:(1)硫酸亚铁易被氧化,需要加入铁粉防止硫酸亚铁被氧化,用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是防止FeSO4被氧气氧化,反应前需将废铁屑用热Na2CO3溶液浸泡是利用碳酸钠溶液的碱性除去铁表面的油污;
(2)n(CO2)=n(MnCO3)=0.01 mol,n(EDTA)=0.0014mol
10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL﹣1=0.0014mol
500mL溶液n(Mn2+)=0.0014mol×![]() =0.07mol
=0.07mol
7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol
n[Mn(OH)2]=0.06 mol
m(H2O)=7.390g﹣0.01mol×115g/mol﹣0.06mol×204g/mol=0.9 g
n(H2O)=![]() =0.05 mol
=0.05 mol
a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O,
故答案为:n(CO2)=n(MnCO3)=0.01 mol n(EDTA)=0.0014mol
10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL﹣1=0.0014mol
500mL溶液n(Mn2+)=0.0014mol×![]() =0.07mol
=0.07mol
7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol
n[Mn(OH)2]=0.06 mol
m(H2O)=7.390g﹣0.01mol×115g/mol﹣0.06mol×204g/mol=0.9 g
n(H2O)=![]() =0.05 mol
=0.05 mol
a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O

【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
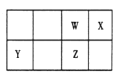
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
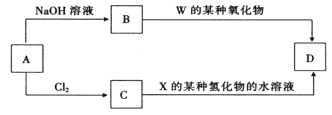
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。