题目内容
10.在一个密闭容器内有A、B、C、D 四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是( )| 物质 | A | B | C | D |
| 反应前质量/g | 4 | 6 | 111 | 4 |
| 反应后质量/g | 待测 | 15 | 0 | 84 |
| A. | 密闭容器中发生的化学反应属于分解反应 | |
| B. | 密闭容器中发生的化学反应属于化合反应 | |
| C. | 反应后密闭容器中A的质量为22g | |
| D. | 该反应中A.B、C、D四种物质的质量比为 26:9:111:80 |
分析 根据质量守恒定律,可计算反应后A物质的质量=(4g+6g+111g+4g)-(15g+84g)=26g;
根据反应前后各物质的质量,可判断反应的反应物、生成物:物质A、B、D反应后质量增大,为反应的生成物;物质C反应后质量减小为0,为反应的反应物;该反应可表示为:C→A+B+D.
解答 解:A、根据反应前后各物质的质量关系,物质A、B、D反应后质量增大,为反应的生成物;物质C反应后质量减小,为反应的反应物;该反应可表示为C→A+B+D,反应为一种物质生成三种物质的分解反应,故A正确;
B、化合反应为多种物质生成一种物质的反应,而该反应为一种物质生成多种物质的反应,不属于化合反应,故B错误;
C、根据质量守恒定律,反应后A物质的质量=(4g+6g+111g+4g)-(15g+84g)=26g≠22g,故C错误;
D、根据反应前后各物质的质量差可计算出参加反应的各物质的质量,可知参加反应的A、B、C、D四种物质的质量比=(26g-4g):(15g-6g):111g:(84g-4g)=22:9:111:80,故D错误;
故选A.
点评 根据反应前后物质的质量关系判断反应的反应物与生成物,反应后质量增大的物质为反应的生成物、质量减小的物质为反应的反应.

练习册系列答案
相关题目
5.下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是( )
| A. | 实验剩余的药品不能放回原试剂瓶 | B. | 可燃性气体的验纯 | ||
| C. | 不能给正燃烧着的酒精灯添加酒精 | D. | 滴管不能交叉使用 |
2.下列实验现象预测正确的是( )
| A. | 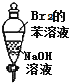 振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 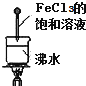 当液体变成红褐色时,停止加热,让光束通过体系时可产生丁达尔效应 |
19.下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃).
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式C6H5OH+PO43-=C6H5O-+HPO42-;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚(C6H5OH)溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是d;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1<T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是D.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点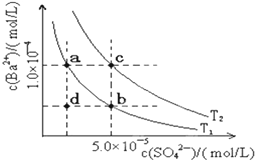
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式C6H5OH+PO43-=C6H5O-+HPO42-;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚(C6H5OH)溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是d;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1<T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是D.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点

20.己知丙烷的燃烧热△H=-2215KJ•mol-1,若一定量的丙烷完全燃烧后生成18g水,则放出的热量约为( )
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1108 kJ |
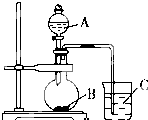 某化学小组设计实验元素周期表中元素的性质,请回答下列问题
某化学小组设计实验元素周期表中元素的性质,请回答下列问题