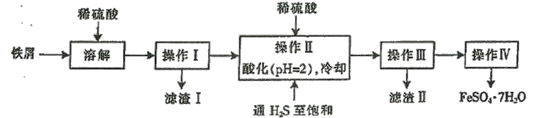
题目内容
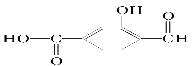
【题目】(1)有BaCl2和KCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗amolH2SO4;另一份滴加AgNO3溶液,消耗bmolAgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为____mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为_____。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平:
___Al+___NO3-+___—___AlO2-+___N2↑+___H2O
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是____。
②若该反应方程式中I2和KIO3的计量数分别是6和3,则生成1molI2时,转移电子的物质的量为___。
【答案】![]() 1.5 1∶2∶2∶1 10 6 4OH 10 3 2 I2、KIO3 5mol
1.5 1∶2∶2∶1 10 6 4OH 10 3 2 I2、KIO3 5mol
【解析】
(1)根据SO42-+Ba2+═BaSO4↓计算溶液中的Ba2+离子的物质的量,根据Ag++Cl-=AgCl↓算Cl-的物质的量,再根据c=![]() 计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(K+)=c(Cl-),据此计算原溶液中的K+浓度;
计算Ba2+离子、Cl-离子浓度,利用电荷守恒有2c(Ba2+)+c(K+)=c(Cl-),据此计算原溶液中的K+浓度;
(2)在一定条件下,PbO2与溶液中Cr3+反应,产物是Cr2O72-和Pb2+,根据电子守恒计算;
(3)用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢和过氧化钠制氧气,O则由-1价转化为0价。现要制得相同的O2,所以用过氧化氢和过氧化钠制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半;
(4)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,根据化合价升降守恒分析配平;
(5)反应KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O中,Mn元素化合价降低,由+7价降低到+2价,被还原,KMnO4为氧化剂,I元素化合价升高,由-1价升高到0价和+5价,KI为还原剂,则氧化产物为I2和KIO3,据此分析解答。
(1)BaCl2和NaCl的混合溶液V L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a molH2SO4,根据SO42-+Ba2+═BaSO4↓,c(Ba2+)=![]() =
=![]() mol/L,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗bmolAgNO3,根据Ag++Cl-=AgCl↓,c(Cl-)=
mol/L,另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗bmolAgNO3,根据Ag++Cl-=AgCl↓,c(Cl-)=![]() =
=![]() mol/L,溶液不显电性,由电荷守恒可知,c(K+)+
mol/L,溶液不显电性,由电荷守恒可知,c(K+)+![]() mol/L×2=
mol/L×2=![]() mol/L,解得c(K+)=
mol/L,解得c(K+)=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(2)在一定条件下,PbO2与溶液中Cr3+反应,产物是Cr2O72-和Pb2+,反应中Cr的价态升高了3价,pb的化合价降低2价,根据化合价升降守恒,所以与1mol Cr3+反应所需PbO2的物质的量为1.5mol,故答案为:1.5;
(3)用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,如生成1mol O2,需转移4mol电子,而用过氧化氢和过氧化钠制氧气,O则由-1价转化为0价,如生成1mol O2,需转移2mol电子,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为1∶2∶2∶1,故答案为:1∶2∶2∶1;
(4)反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降的最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知系数为,由H元素守恒可知系数为,故配平后离子方程式为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,故答案为:10;6;4OH-;10;3;2;
(5)①反应中Mn元素化合价降低,被还原,I元素化合价由-1价分别变化为0价、+5价,则I2、KIO3 为氧化产物,故答案为:I2、KIO3;
②若该反应方程式中I2和KIO3的计量数分别是6和3,则生成1molI2时,同时生成0.5molKIO3,则I元素失去电子的数目为2×1(1-0)mol+0.5×[5-(-1)]mol=5mol,即反应过程中转移电子的物质的量为5mol,故答案为:5mol。

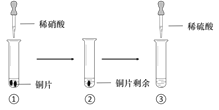
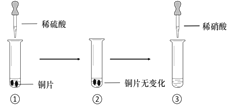
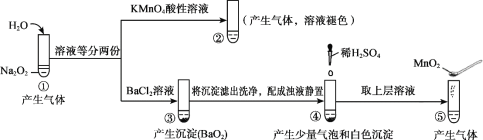
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O