题目内容
2.下列实验基本操作正确的是( )| A. | 经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等 | |
| B. | 中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL | |
| D. | 用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6 |
分析 A.醋酸为弱电解质,电离吸热;
B.环形铁丝搅拌棒导热性强;
C.碱式滴定管量取碱性溶液,且能准确到0.01mL;
D.广范pH试纸,只能测定整数.
解答 解:A.醋酸为弱电解质,电离吸热,则等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量不等,醋酸与碱反应放出的热量少,故A错误;
B.环形铁丝搅拌棒导热性强,不能代替环形玻璃搅拌棒,否则测定中和热偏小,故B错误;
C.碱式滴定管量取碱性溶液,且能准确到0.01mL,则用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL,故C正确;
D.广范pH试纸,只能测定整数,不能得到pH=3.6,故D错误;
故选C.
点评 本题考查化学实验方案的设计,为高频考点,涉及中和热及测定、仪器使用、pH的测定等,把握反应原理及实验基本操作为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
12.下列关于热化学反应的描述中不正确的是( )
| A. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | 1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷燃烧热 | |
| D. | 需要加热才能发生的反应不一定是吸热反应 |
13.埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是( )
| A. | 在潮湿疏松透气的土壤中 | B. | 在干燥致密不透气的土壤中 | ||
| C. | 在含铁元素较多的酸性土壤中 | D. | 在含碳粒较多,潮湿透气的土壤中 |
10.把碘从碘和砂子的混合物中分离出来,可用的方法是( )
| A. | 过滤 | B. | 结晶 | C. | 蒸馏 | D. | 升华 |
7.(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CD.
A.它们均由甲烷去掉一个氢原子所得 B.它们碳原子均采取sp2杂化
C.CH3-与NH3、H3O+几何构型均为三角锥形 D.CH3+中的碳原子采取sp2杂化,所有原子均共面
(2)N2与O22+互为等电子体,O22+的电子式可表示为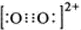 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.
(3)X、Y两种有机物的分子结构和部分物理性质如下表,二者物理性质有差异的主要原因是X物质形成分子内氢键,Y物质形成分子间氢键.
A.它们均由甲烷去掉一个氢原子所得 B.它们碳原子均采取sp2杂化
C.CH3-与NH3、H3O+几何构型均为三角锥形 D.CH3+中的碳原子采取sp2杂化,所有原子均共面
(2)N2与O22+互为等电子体,O22+的电子式可表示为
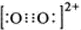 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.(3)X、Y两种有机物的分子结构和部分物理性质如下表,二者物理性质有差异的主要原因是X物质形成分子内氢键,Y物质形成分子间氢键.
| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X | 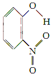 | 0.2 | 45 | 100 |
| Y | 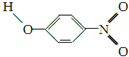 | 1.7 | 114 | 295 |
14.下列离子方程式正确的是( )
| A. | 铜片加入稀盐酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 盐酸滴加在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓ |
11.水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3-、5表示Pb(OH)42-]
(1)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子除H+、Na+外,还有:Pb2+、Pb(OH)+.
(2)pH=9时主要反应的离子方程式是:Pb(OH)++OH-?Pb(OH)2↓
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
上表中除 Pb2+外,该脱铅剂对其他离子的去除效果最好的是:Fe3+
(4)如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+
则脱铅最合适的pH范围为B(填代码).
A.4~5 B.6~7 C.9~10 D.11~12.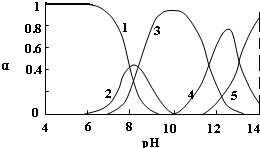
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3-、5表示Pb(OH)42-]
(1)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子除H+、Na+外,还有:Pb2+、Pb(OH)+.
(2)pH=9时主要反应的离子方程式是:Pb(OH)++OH-?Pb(OH)2↓
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度(mg/L) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度(mg/L) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(4)如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+
则脱铅最合适的pH范围为B(填代码).
A.4~5 B.6~7 C.9~10 D.11~12.

12.能正确表示下列化学反应的离子方程式是( )
| A. | 单质铁与盐酸的反应 Fe+2 H+=Fe2++H2↑ | |
| B. | 氨水跟硫酸发生酸碱中和反应 OH-+H+=H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙加入醋酸溶液中 CaCO3+2CH3COOH=CO2↑+2CH3COO-+H2O+Ca2+ |