题目内容
14.下列离子方程式正确的是( )| A. | 铜片加入稀盐酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 盐酸滴加在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓ |
分析 A.不符合反应客观事实;
B.碳酸钙为沉淀,应保留化学式;
C.离子个数配比不符合物质的结构;
D.硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化铜沉淀.
解答 解:A.铜与盐酸不反应,故A错误;
B.盐酸滴加在石灰石上,离子方程式:CaCO3+2H+=H2O+CO2↑+Ca2+,故B错误;
C.氢氧化钡溶液与稀硫酸混合,离子方程式:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故C错误;
D.硫酸铜溶液与氢氧化钡溶液反应,离子方程式:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确发生反应的实质是解题关键,注意离子方程式书写应遵循客观事实、遵循原子个数、电荷数守恒规律,注意化学式的拆分.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列说法正确的是( )
| A. | 原子晶体都是单质 | |
| B. | 分子晶体在常温下不可能为固态 | |
| C. | 非金属元素的气态氢化物越稳定,其氧化物对应的水化物酸性越强 | |
| D. | 非金属元素的气态氢化物相对分子质量越大,熔沸点不一定越高 |
2.下列实验基本操作正确的是( )
| A. | 经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等 | |
| B. | 中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL | |
| D. | 用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6 |
9.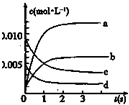 在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{c(XY{\;}_{2}){\;}^{2}}{c(XY){\;}^{2}c(Y{\;}_{2})}$.
(2)如图中表示XY2的变化的曲线是b.用Y2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•S-1.
(3)能说明该反应已达到平衡状态的是B.
A.v(XY2)=2v(Y2)
B.容器内压强保持不变
C.XY、Y2、XY2的浓度之比为2:1:2
D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(XY)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示XY2的变化的曲线是b.用Y2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•S-1.
(3)能说明该反应已达到平衡状态的是B.
A.v(XY2)=2v(Y2)
B.容器内压强保持不变
C.XY、Y2、XY2的浓度之比为2:1:2
D.容器内密度保持不变.
19.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O═2HBr+H2SO4,下列说法正确的是( )
| A. | Br2在反应中表现氧化性 | B. | SO2在反应中被还原 | ||
| C. | Br2在反应中得电子 | D. | 1mol氧化剂在反应中得到1mol电子 |
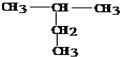 :2-甲基丁烷
:2-甲基丁烷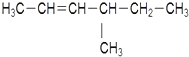 :4-甲基-2-己烯
:4-甲基-2-己烯 1,3-二甲苯.
1,3-二甲苯.