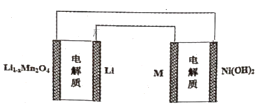
题目内容
【题目】如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。

(1)打开K2,合并K1。A的电极反应为________。最终可观察到的现象是________________。
(2)打开K1,合并K2。F极的电极反应为_______,检验F极产生气体的方法是____________。
(3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是_____,原因是____________。
【答案】O2+2H2O+4e-=4OH- 溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色 2Cl--2e-=Cl2↑ 用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气; A、E 因为A极氧气放电产生氢氧根,E极上水放电产生氢气和氢氧根离子,均导致电极区域呈碱性
【解析】
当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,负极为铁,石墨作正极,发生吸氧腐蚀,当打开K1,闭台K2时,铁片、石墨和NaCl溶液,构成电解池,说明作阳极,铁作阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,可以用湿润的淀粉碘化钾试纸检验氯气。
(1)打开K2,闭合K1后,构成原电池,B是铁片,作负极,A是正极,由于溶液是氯化钠溶液,因此相当于铁的吸氧腐蚀,正极反应式为O2+2H2O+4e-=4OH-。铁失去电子生成亚铁离子,然后结合OH-生成Fe(OH)2沉淀,最终被氧化生成氢氧化铁沉淀,实验现象为溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色,故本题答案为: O2+2H2O+4e-=4OH-;溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色;
(2)打开K1,闭合K2,装置是电解池,F是阳极,E是阴极,阳极氯离子放电,生成氯气,电极反应式为:2Cl--2e-=Cl2↑,可利用氯气的氧化性来检验,即生成了碘单质,用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气,故本题答案为:2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气;
(3)由(1)、(2)分析可知,OH-在A和E两极出现,酚酞遇OH-变红,所以溶液变红,故本题答案为:A、E;因为A极氧气放电产生氢氧根,E极上水放电产生氢气和氢氧根离子,均导致电极区域呈碱性。