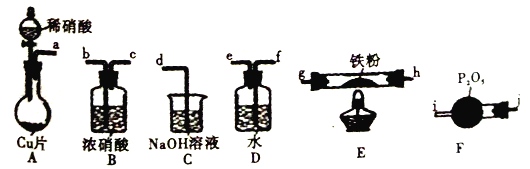
题目内容
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL0.2mol·L-1盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.287g。
下列说法中正确的是( )
A.该溶液中一定不含Ba2+、Mg2+、Al3+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应实验(透过蓝色钴玻璃片)
D.可能含有Cl-
【答案】B
【解析】
①加氢氧化钠溶液过程中无沉淀生成,说明溶液中一定不存在A13+、Mg2+;②另取少量原溶液,逐滴加入5mL0.2molL-1盐酸,开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失,产生和溶解的沉淀为氢氧化铝,产生的气体为二氧化碳,说明溶液中存在AlO2-、CO32-,所以一定不存在SiO32-、Ba2+,根据溶液呈电中性,溶液中一定存在K+;③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0. 287g,沉淀为AgCl,物质的量为![]() =0.002mol>n(HCl)=0.005L×0.2mol/L=0.001mol,所以原溶液中一定存在0.001molCl-,据此分析解答。
=0.002mol>n(HCl)=0.005L×0.2mol/L=0.001mol,所以原溶液中一定存在0.001molCl-,据此分析解答。
A.根据以上分析可知,溶液中一定不存在Ba2+、Mg2+、A13+、SiO32-,一定存在Cl-,故A错误;
B.由上述分析可知:该溶液中一定含有K+、AlO2-、CO32-、Cl-,故B正确;
C.根据溶液的电中性可以判断,溶液中一定存在K+,不需要通过焰色反应判断K+是否存在,故C错误;
D.根据分析可知,原溶液中一定存在Cl-,故D错误;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】某地环保部门将收集到的一定量酸雨试样分成甲、乙、丙、丁四份,进行如图所示的实验探究。
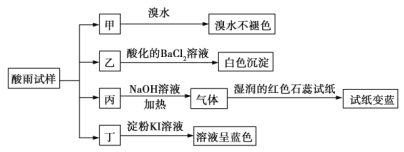
已知酸雨试样中可能含有下表所示的某些离子:
阳离子 |
|
阴离子 |
|
请回答下列问题:
(1)![]() 是______,
是______,![]() 是______。
是______。
(2)可能存在的阴离子是______,能证明该阴离子是否存在的简单实验操作为______。
(3)写出丁试样中滴加淀粉![]() 溶液所发生反应的离子方程式:______。
溶液所发生反应的离子方程式:______。
(4)某次降雨收集到![]() 雨水,向雨水中滴加
雨水,向雨水中滴加![]() 的
的![]() 溶液,充分反应后测得溶液中
溶液,充分反应后测得溶液中![]() ,再向该溶液中加入足量的
,再向该溶液中加入足量的![]() 溶液,经过滤、蒸干、称重,测得沉淀的质量为
溶液,经过滤、蒸干、称重,测得沉淀的质量为![]() 。假设雨水的酸性仅由
。假设雨水的酸性仅由![]() 和
和![]() 的排放所致,则排放到空气中的
的排放所致,则排放到空气中的![]() 和
和![]() 的物质的量之比约为______(不考虑
的物质的量之比约为______(不考虑![]() 的相互反应)。
的相互反应)。