题目内容
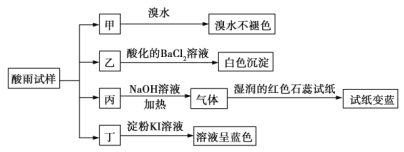
【题目】某地环保部门将收集到的一定量酸雨试样分成甲、乙、丙、丁四份,进行如图所示的实验探究。
已知酸雨试样中可能含有下表所示的某些离子:
阳离子 |
|
阴离子 |
|
请回答下列问题:
(1)![]() 是______,
是______,![]() 是______。
是______。
(2)可能存在的阴离子是______,能证明该阴离子是否存在的简单实验操作为______。
(3)写出丁试样中滴加淀粉![]() 溶液所发生反应的离子方程式:______。
溶液所发生反应的离子方程式:______。
(4)某次降雨收集到![]() 雨水,向雨水中滴加
雨水,向雨水中滴加![]() 的
的![]() 溶液,充分反应后测得溶液中
溶液,充分反应后测得溶液中![]() ,再向该溶液中加入足量的
,再向该溶液中加入足量的![]() 溶液,经过滤、蒸干、称重,测得沉淀的质量为
溶液,经过滤、蒸干、称重,测得沉淀的质量为![]() 。假设雨水的酸性仅由
。假设雨水的酸性仅由![]() 和
和![]() 的排放所致,则排放到空气中的
的排放所致,则排放到空气中的![]() 和
和![]() 的物质的量之比约为______(不考虑
的物质的量之比约为______(不考虑![]() 的相互反应)。
的相互反应)。
【答案】![]()
![]()
![]() 取少量酸雨试样,滴加足量的
取少量酸雨试样,滴加足量的![]() 溶液,静置,取上层清液,滴加
溶液,静置,取上层清液,滴加![]() 溶液,若有白色沉淀产生,则存在
溶液,若有白色沉淀产生,则存在![]() ;若无由色沉淀产生,则不存在
;若无由色沉淀产生,则不存在![]()
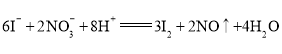
![]()
【解析】
酸雨试样加入溴水,溴水不褪色,说明酸雨试样不含还原性离子,所以不含![]() ;
;
酸雨试样加入氢氧化钠并加热,有氨气放出,说明酸雨试样中含有![]() ;酸雨试样加入淀粉碘化钾,溶液变蓝,说明有碘单质生成,酸雨试样含有氧化性离子,所以酸雨试样中含有
;酸雨试样加入淀粉碘化钾,溶液变蓝,说明有碘单质生成,酸雨试样含有氧化性离子,所以酸雨试样中含有![]() ;酸雨试样加入BaCl2溶液生成白色沉淀,说明酸雨试样含有
;酸雨试样加入BaCl2溶液生成白色沉淀,说明酸雨试样含有![]() ;
;
(1)根据以上分析,溶液中一定含有![]() 、
、![]() 、
、![]() ,一定不含
,一定不含![]() ;所以
;所以![]() 是
是![]() ,
,![]() 是
是![]() 。
。
(2)根据以上分析,可能存在的阴离子是![]() ,
,![]() 与银离子反应生成难溶于硝酸的白色沉淀氯化银,能证明
与银离子反应生成难溶于硝酸的白色沉淀氯化银,能证明![]() 是否存在的简单实验操作为:取少量酸雨试样,滴加足量的
是否存在的简单实验操作为:取少量酸雨试样,滴加足量的![]() 溶液,静置,取上层清液,滴加
溶液,静置,取上层清液,滴加![]() 溶液,若有白色沉淀产生,则存在
溶液,若有白色沉淀产生,则存在![]() ;若无由色沉淀产生,则不存在
;若无由色沉淀产生,则不存在![]() 。
。
(3)酸雨试样加入淀粉碘化钾,溶液变蓝,说明碘离子被硝酸氧化为碘单质,试样中滴加淀粉![]() 溶液所发生反应的离子方程式是
溶液所发生反应的离子方程式是![]() 。
。
(4)![]() 雨水,向雨水中滴加
雨水,向雨水中滴加![]() 的
的![]() 溶液,亚硫酸根离子被氧化为硫酸根离子,充分反应后测得溶液中
溶液,亚硫酸根离子被氧化为硫酸根离子,充分反应后测得溶液中![]() ,再向该溶液中加入足量的
,再向该溶液中加入足量的![]() 溶液,经过滤、蒸干、称重,生成硫酸钡沉淀的质量为
溶液,经过滤、蒸干、称重,生成硫酸钡沉淀的质量为![]() ,硫酸钡的物质的量是
,硫酸钡的物质的量是![]() 0.0008mol,硫酸的浓度为
0.0008mol,硫酸的浓度为![]() =
=![]() ,氢离子由硫酸、硝酸共同提供,所以硝酸的浓度是
,氢离子由硫酸、硝酸共同提供,所以硝酸的浓度是![]() ,则排放到空气中的
,则排放到空气中的![]() 和
和![]() 的物质的量之比约为1:1。
的物质的量之比约为1:1。

【题目】某化学兴趣小组用中和滴定法测定一瓶烧碱溶液的浓度(该烧碱溶液中不含与酸反应的杂质),测定过程如下:
a.将锥形瓶置于酸式滴定管下,锥形瓶下垫一张白纸;
b.分别取25.00mL酸、碱滴定管各一支,洗涤并用待装液润洗;
c.打开酸式滴定管旋塞开始滴定直到终点,记录下终点时滴定管上的读数;
d.取一个用蒸馏水洗净的锥形瓶,从碱式滴定管中放出20.00mL待测碱液于锥形瓶中,滴入2至3滴酚酞试液;
e.碱式滴定管中加入待测烧碱溶液,酸式滴定管中加入0.1000mol·L-1的稀盐酸标准溶液,并将两支滴定管尖嘴部分的气泡均赶尽,记下液面刻度;
f.再重复上述操作2次。
三次测定获得的数据如下表:
实验次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 0.45 | 24.40 |
2 | 20.00 | 2.20 | 26.25 |
3 | 20.00 | 0.10 | 17.10 |
(1)上述实验操作的正确顺序是___(填字母序号)。
(2)实验中,除用酚酞作指示剂外,还可以选用___作该实验的指示剂,在锥形瓶下垫一张白纸的作用是___。
(3)如何判断滴定达到了终点?___
(4)根据实验数据,计算待测碱液的浓度为___mol·L-1(保留两位小数)。
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是___。(填正确答案标号)
A.操作b中,未润洗酸式滴定管
B.操作e中,碱式滴定管尖嘴处的气泡未赶出,而取液后其尖嘴处的气泡消失了
C.操作d中,装碱液时,锥形瓶中还有少量蒸馏水
D.操作c中,滴定终点时发现酸式滴定管尖嘴处悬挂着一滴溶液
E.酸式滴定管读数时,滴定前仰视读数,滴定结束时俯视读数