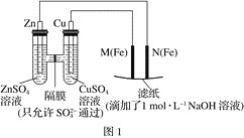
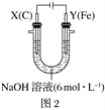
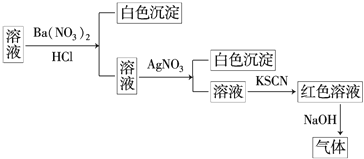
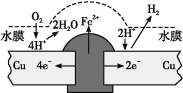
题目内容
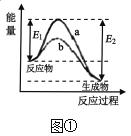
【题目】已知在200℃,101kPa下,氢气与碘蒸气混合发生应:H2(g)+I2(g)![]() 2HI(g),则下列叙述正确的是( )
2HI(g),则下列叙述正确的是( )
A.反应达平衡后,增大压强(缩小容器体积),混合气体颜色不变
B.由反应需在200℃进行可推测该反应是吸热反应
C.反应达平衡后,保持容器体积不变,充入大量I2蒸气可提高H2的转化率
D.当v(H2)生成:v(HI)生成=2:1时,反应达到平衡状态
【答案】C
【解析】
A.反应达到平衡以后,由于反应前后气体系数和相同,故压缩体积增大压强不会影响化学平衡的移动,但由于体积减小,单位体积内I2的含量增大,混合气体颜色变深,A错误;
B.该反应为化合反应,常见的化合反应都是放热反应,B错误;
C.反应达到平衡以后,向容器内添加大量的I2,增加了反应物的浓度,平衡向正向移动,H2的转化率增加,C正确;
D.化学反应速率比与化学计量数比相同,当达到平衡状态时,反应物的生成速率与生成物的生成速率比等于对应的化学计量数比,故v(H2)生成:v(HI)生成=1:2,D错误;
故选C。

【题目】某化学兴趣小组用中和滴定法测定一瓶烧碱溶液的浓度(该烧碱溶液中不含与酸反应的杂质),测定过程如下:
a.将锥形瓶置于酸式滴定管下,锥形瓶下垫一张白纸;
b.分别取25.00mL酸、碱滴定管各一支,洗涤并用待装液润洗;
c.打开酸式滴定管旋塞开始滴定直到终点,记录下终点时滴定管上的读数;
d.取一个用蒸馏水洗净的锥形瓶,从碱式滴定管中放出20.00mL待测碱液于锥形瓶中,滴入2至3滴酚酞试液;
e.碱式滴定管中加入待测烧碱溶液,酸式滴定管中加入0.1000mol·L-1的稀盐酸标准溶液,并将两支滴定管尖嘴部分的气泡均赶尽,记下液面刻度;
f.再重复上述操作2次。
三次测定获得的数据如下表:
实验次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 0.45 | 24.40 |
2 | 20.00 | 2.20 | 26.25 |
3 | 20.00 | 0.10 | 17.10 |
(1)上述实验操作的正确顺序是___(填字母序号)。
(2)实验中,除用酚酞作指示剂外,还可以选用___作该实验的指示剂,在锥形瓶下垫一张白纸的作用是___。
(3)如何判断滴定达到了终点?___
(4)根据实验数据,计算待测碱液的浓度为___mol·L-1(保留两位小数)。
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是___。(填正确答案标号)
A.操作b中,未润洗酸式滴定管
B.操作e中,碱式滴定管尖嘴处的气泡未赶出,而取液后其尖嘴处的气泡消失了
C.操作d中,装碱液时,锥形瓶中还有少量蒸馏水
D.操作c中,滴定终点时发现酸式滴定管尖嘴处悬挂着一滴溶液
E.酸式滴定管读数时,滴定前仰视读数,滴定结束时俯视读数