题目内容
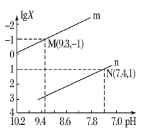
【题目】如图表示反应2SO2(g)+O2(g)![]() 2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
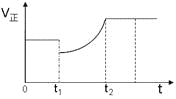
A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
【答案】A
【解析】
A、t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应移动,达新平衡时反应物浓度比原平衡时大,正反应速率比原平衡速率大,故A正确;
B、t1降低了温度,平衡向正反应移动,重新平衡时的速率小于原平衡速率,故B错误;
C、t1时减小了压强,平衡向逆反应方向移动,重新平衡时的速率小于原平衡速率,故C错误;
D、t1时增加了SO2和O2的浓度,正反应速率应大于原平衡速率,平衡向正反应方向移动,故D错误;
故选A。

 应用题作业本系列答案
应用题作业本系列答案【题目】某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ____________ | ____________ |
验证不稳定性 | ____________ | ____________ |
【题目】某小组研究第3周期元素性质的递变规律,设计了如下实验,并记录了实验现象:
实验步骤 | 实验现象 |
①将一小块钠放入滴有酚酞的冷水中 | A.有气体产生,溶液变成浅红色 |
②将用砂纸打磨过的镁条放入沸水中,再向其中滴加少量酚酞溶液 | B.浮在水面上,熔成小球,做不定向运动,随后消失,溶液变为红色 |
③将镁条放入稀盐酸中 | C.反应较快,产生无色气体 |
④将铝条放入稀盐酸中 | D.反应剧烈,迅速产生大量无色气体 |
(1)补齐实验步骤与实验现象之间的连线___________。

(2)由上述实验可知Na、Mg、Al三种元素原子失电子能力(金属性)依次_______(填“增强”或“减弱”)。从原子结构的角度解释原因____________。
(3)比较第3周期中硫与氯两种元素原子得电子能力(非金属性)的相对强弱。
①甲同学设计的下列方法可行的是_______。
A.比较气态氢化物的稳定性 B.比较盐酸与硫酸的酸性 C.比较单质与酸反应置换出氢气的难易程度
②乙同学设计将氯气通入硫化钠溶液中,观察是否有淡黄色沉淀生成。这一实验的设计思路是通过比较________,推知元素原子得电子能力的相对强弱。
(4)利用元素周期律可预测陌生元素及物质的性质,已知Rb与Na处于同一主族,下列说法正确的是_____。
A.失电子能力:Rb>Na B.碱性:NaOH>RbOH C.Rb比Na更容易与氧气发生反应 D.Rb不易与水反应放出H2