题目内容
【题目】H2C2O4是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,下列溶液的离子浓度关系式正确的是( )
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2molL-1
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
【答案】C
【解析】
A.![]() 的
的![]() 溶液中,
溶液中,![]() ,
,![]() 存在两步电离,则
存在两步电离,则![]() 大于
大于![]() ,故A错误;
,故A错误;
B.![]() 的
的![]() 溶液与
溶液与![]() 的NaOH溶液任意比例混合,根据电荷守恒应有
的NaOH溶液任意比例混合,根据电荷守恒应有![]() ,故B错误;
,故B错误;
C.根据![]() ,
,![]() ,所以将NaOH溶液滴加到
,所以将NaOH溶液滴加到![]() 溶液中至混合溶液呈中性时溶液中主要溶质应是草酸钠和草酸氢钠,
溶液中至混合溶液呈中性时溶液中主要溶质应是草酸钠和草酸氢钠,![]() -的水解常数
-的水解常数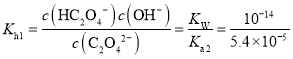 ,中性溶液
,中性溶液![]() ,则
,则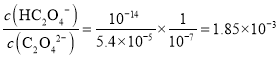 ,所以应有
,所以应有![]() ,故C正确;
,故C正确;
D.在![]() 溶液中,根据
溶液中,根据![]() 的水解常数
的水解常数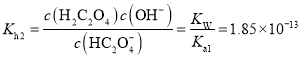 ,
,![]() ,则
,则![]() 的电离程度大于水解程度,所以应有
的电离程度大于水解程度,所以应有![]() ,故D错误;
,故D错误;
答案选C。

练习册系列答案
相关题目
【题目】下列有关说法正确且解释合理的是
说法 | 解释 | |
A | 一定温度压强下,2 g H2 和 4 g H2 完全燃烧,后者 燃烧热的数值大 | 4 g H2 放出热量多 |
B | 2SO2(g)+O2(g) 平衡后再加入 SO2,Q 增大 | 平衡右移,放出热量增多 |
C | 向等物质的量浓度的 NaI 和 KBr 混合液中滴加 AgNO3 溶液,先生成黄色 AgI 沉淀 | Ksp(AgI)<Ksp(AgBr) |
D | 等物质的量浓度 Na2CO3 的 pH 大于 CH3COONa | H2CO3 的酸性比 CH3COOH 强 |
A.AB.BC.CD.D