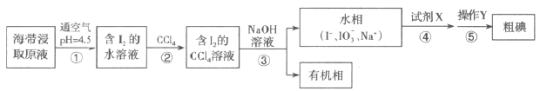
题目内容
【题目】一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和代表不同元素的原子。关于此反应说法错误的是

A.一定属于化合反应
B.一定属于可逆反应
C.一定属于吸热反应
D.一定属于氧化还原反应
【答案】C
【解析】
A.两种或者多种物质生成一种物质的反应是化合反应,根据图示可知,此反应的反应物有两种,反应后生成一种化合物,且有反应物剩余,故A正确;
B.由图可知,反应前后均存在反应物分子,该反应为可逆反应,故B正确;
C.反应吸放热与反应类型无必然关系,故根据图示无法确定反应是吸热还是放热,故C错误;
D.有元素发生化合价变化的反应为氧化还原反应,而有单质参与的化合反应一定是氧化还原反应,故此反应为氧化还原反应,故D正确;
故选C。

【题目】(1)实验测得5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:___________________________。
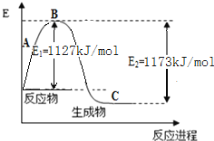
(2)现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意如图。根据下列已知键能数据计算N-H键键能为____________________kJ/mol 。
化学键 | H-H |
|
键能(kJ/mol) | 436 | 946 |
(3)用如图所示装置进行中和热测定实验,请回答下列问题:
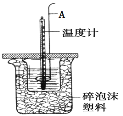
仪器A的名称为 ________________________ 。
取30mLH2SO4(0.5mol·L-1)溶液与50mLNaOH(0.5mol·L-1)溶液在小烧杯中进行中和反应,三次实验温度平均升高4.1℃,已知中和后生成的溶液的比热容为![]() ,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
上述实验数值结果与57.3kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
实验中若改用60mLH2SO4(0.25mol·L-1)溶液与50mLNaOH(0.55 mol·L-1)溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”、“不相等”),所求中和热 _____ (填“相等”、“不相等”),若用50mL0.5mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ______ (填“偏大”、“偏小”、“不受影响”)。