题目内容
2.下列反应的离子方程式正确的是( )| A. | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2OA1O2═+4NH4++2H2O | |
| B. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| C. | 酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | 浓盐酸与铁屑反应:Fe+2H+═Fe2++H2↑ |
分析 A.向AlCl3溶液中加入过量的浓氨水,反应生成氢氧化铝和氯化铵;
B.原子个数不守恒;
C.酸性条件下,不能生成氢氧根离子;
D.浓盐酸与铁屑反应生成氯化亚铁和氢气.
解答 解:A.向AlCl3溶液中加入过量的浓氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.少量金属钠加到冷水中:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.酸性条件下,KIO3溶液与KI溶液反应,离子方程式:IO3-+5I-+6H+=3I2+3H2O,故C错误;
D.浓盐酸与铁屑反应,离子方程式:Fe+2H+═Fe2++H2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应必须符合客观事实,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
8.下列物质中,含极性键和非极性键且分子有极性的是( )
| A. | 乙烯 | B. | H2O2 | C. | 甲烷 | D. | 三氯甲烷 |
10.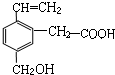 某有机物的结构简式如图,该物质应有的化学性质是( )
某有机物的结构简式如图,该物质应有的化学性质是( )
①可燃烧;
②可跟溴加成;
③可使酸性KMnO4溶液褪色;
④可跟NaHCO3溶液反应
⑤可跟Cu(OH)2反应;
⑥可跟金属钠反应
⑦可生成高分子化合物.
 某有机物的结构简式如图,该物质应有的化学性质是( )
某有机物的结构简式如图,该物质应有的化学性质是( )①可燃烧;
②可跟溴加成;
③可使酸性KMnO4溶液褪色;
④可跟NaHCO3溶液反应
⑤可跟Cu(OH)2反应;
⑥可跟金属钠反应
⑦可生成高分子化合物.
| A. | ①②③⑥ | B. | ②③④⑥ | C. | ①②③④⑤⑥⑦ | D. | ②③④⑥ |
17.常温下,下列各组比值为1:2的是( )
| A. | 0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 | |
| B. | 0.1 mol/L H2S溶液,c(S2-)与c(H+)之比 | |
| C. | pH=10的Ba(OH)2溶液与pH=10的氨水,溶质的物质的量浓度之比 | |
| D. | pH=3的硫酸与pH=3的醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
11.在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示.极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量.分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d•q.下列分子中μ=0的是( )
| A. | HCl | B. | CS2 | C. | H2S | D. | SO2 |
12.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率为0.8mol•L-1•s-1,是指在1s时某物质的浓度是0.8mol•L-1 | |
| B. | 化学反应速率是指在一段时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 | |
| C. | 化学反应速率可以衡量化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象越明显 |
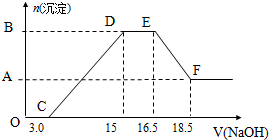 HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种.现有一定量的Al粉和Fe粉的混合物与100mL,稀HNO3充分反应,反应过程中无任何气放出.在反应结束后的溶液中,逐渐加入4mol•L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的物质的量关系如图.请回答:
HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种.现有一定量的Al粉和Fe粉的混合物与100mL,稀HNO3充分反应,反应过程中无任何气放出.在反应结束后的溶液中,逐渐加入4mol•L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的物质的量关系如图.请回答: