题目内容
【题目】二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) =CH3OCH3(g)+H2O(g) ΔH1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) ![]() CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1
③2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1 453.0 kJ·mol-1;1 mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E (kJ · mol-1) | 436 | 343 | 465 | 453 | 413 |
则ΔH1=______kJ·mol-1;ΔH3=______ kJ·mol-1
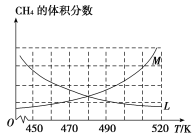
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4)∶n(O2)=2∶1混合,能正确反映反应①中CH4 的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500 K时的2 L的密闭容器中充入2 mol CO和6 mol H2,8 min达到平衡,平衡时CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500 K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因____________________。
【答案】-283.6 -24  M BD 0.2 mol/(L·min) 2.25 > Qc=
M BD 0.2 mol/(L·min) 2.25 > Qc= =
=![]() =1< 2.25,反应正向进行,v(正)>v(逆)
=1< 2.25,反应正向进行,v(正)>v(逆)
【解析】
(1)根据反应热ΔH=反应物的总键能-生成物的总键能进行计算;
(2)平衡常数K为生成物浓度幂之积除以反应物浓度幂之积;反应①为放热反应,温度升高,平衡逆向移动,CH4的体积分数随温度升高而升高,据此判断;
制备原理Ⅰ中,由于是在恒温、恒容的密闭容器中合成,且反应①各物质均是,
A.该反应气体总质量不变,体积不变,混合气体的密度一直不变;
B.当反应容器中各物质的百分含量不变时,该反应达到平衡状态;
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比在任何时候都成立,不一定是平衡状态;
D.该装置是恒容容器,反应为非等体积反应,混合气体的压强不变时达到平衡状态;
(3)根据三段法计算平衡时各物质的浓度,利用v=![]() 计算氢气的速率及平衡常数;利用平衡常数和浓度商之间的关系判断平衡移动的方向。
计算氢气的速率及平衡常数;利用平衡常数和浓度商之间的关系判断平衡移动的方向。
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1 453.0 kJ·mol-1;得到甲烷、二甲醚的燃烧热化学方程式分别为④CH4(g)+2O2(g) =CO2(g)+2H2O(l) ΔH4=-890.3 kJ·mol-1;⑤CH3OCH3(g)+3O2(g) ![]() 2CO2(g)+3H2O(l) ΔH5=-1 453.0 kJ·mol-1;故④×2-⑤=①得到:2CH4(g)+O2(g) =CH3OCH3(g)+H2O(l),且1 mol 液态水变为气态水要吸收44.0 kJ的热量,故则ΔH1=(-890.3×2+1 453+44.0) kJ·mol-1=-283.6 kJ·mol-1,根据所给键能,③2CH3OH(g)
2CO2(g)+3H2O(l) ΔH5=-1 453.0 kJ·mol-1;故④×2-⑤=①得到:2CH4(g)+O2(g) =CH3OCH3(g)+H2O(l),且1 mol 液态水变为气态水要吸收44.0 kJ的热量,故则ΔH1=(-890.3×2+1 453+44.0) kJ·mol-1=-283.6 kJ·mol-1,根据所给键能,③2CH3OH(g) ![]() CH3OCH3(g)+H2O(g),反应物总键能-生成物总键能=反应热,故ΔH3=-24 kJ·mol-1;
CH3OCH3(g)+H2O(g),反应物总键能-生成物总键能=反应热,故ΔH3=-24 kJ·mol-1;
(2)反应③的化学平衡常数表达式为K= ;反应①是放热反应,故温度升高,平衡逆向移动,CH4的体积分数随温度升高而升高,故能正确反映反应①中CH4的体积分数随温度变化的曲线是M;
;反应①是放热反应,故温度升高,平衡逆向移动,CH4的体积分数随温度升高而升高,故能正确反映反应①中CH4的体积分数随温度变化的曲线是M;
制备原理Ⅰ中,由于是在恒温、恒容的密闭容器中合成,且反应①各物质均是气态,
A.混合气体的密度一直不变,不能说明反应达到平衡状态;
B.当反应容器中二甲醚的百分含量不变时,该反应达到平衡状态;
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比在任何时候都成立,故不能说明反应达到平衡状态;
D.该装置是恒容容器,混合气体的压强不变,说明气体总物质的量不变,且该反应前后气体分子总数不等,故达到平衡状态;故选BD;
(3)由合成气制备二甲醚:
②CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始时(mol/L) 1 3 0
转化(mol/L) 0.8 1.6 0.8
平衡时(mol/L) 0.2 1.4 0.8
③2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)
起始时(mol/L) 0.8 0 0
转化(mol/L) 0.6 0.3 0.3
平衡时(mol/L) 0.2 0.3 0.3
H2表示反应②的速率是v(H2)=![]() mol·L-1·min-1=0.2 mol/(L·min);可逆反应③的平衡常数K3=
mol·L-1·min-1=0.2 mol/(L·min);可逆反应③的平衡常数K3= =
=![]() =2.25;若在500 K时,测得容器中n(CH3OH)=n(CH3OCH3),则说明c(CH3OH)=c(CH3OCH3)=c(H2O),则此时Qc=
=2.25;若在500 K时,测得容器中n(CH3OH)=n(CH3OCH3),则说明c(CH3OH)=c(CH3OCH3)=c(H2O),则此时Qc= =
=![]() =1< 2.25,故反应正向进行,v(正)>v(逆)。
=1< 2.25,故反应正向进行,v(正)>v(逆)。

【题目】Ⅰ、已知:SiHCl3在催化剂作用下可发生如下反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=30kJ·mol1
(1)写出由SiHCl3(g)分解产生SiH4(g)和SiCl4(g)的热化学方程式为__。
Ⅱ、298K时,溶液中存在如下反应:A(aq)![]() B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
c/(mol·L-1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
回答下列问题:
(2)该反应在50~80min内的平均反应速率为__mol·L1·min1。
(3)120min时A的转化率为__。
(4)298K时,该反应的平衡常数K=__,升温时平衡常数__(填“增大”、“减小”、或“不变”)。
(5)为提高A的平衡转化率,除适当控制反应温度外,还可采取的措施是__。
(6)下列叙述可说明可逆反应已达平衡的是__。
A.c(A)=c(B)
B.A和B反应速率相等
C.A和B的物质的量比值保持恒定
D.溶液的总质量保持恒定


